
分析 A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素,
(1)A2B为H2O,为共价化合物;
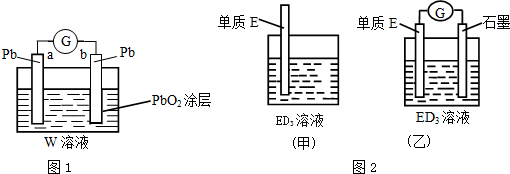
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,铁失去电子发生氧化反应生成二价铁.
解答 解:A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,A、B、C、D四种短周期元素,其原子序数依次增大,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D应为Cl元素.
(1)A2B2为H2O,为共价化合物,结构式为H-O-H,
故答案为:H-O-H;
(2)CB2通入A2B2溶液中可被氧化为W,则w为H2SO4,形成铅蓄电池,负极反应为Pb-2e-+SO42-=PbSO4,反应的总方程式为PbO2+Pb+2H2SO4=2PbSO4+2H2O,a极消耗0.05mol Pb,则消耗0.1molH2SO4,已知溶液体积为1L,且H2SO4的浓度由质量分数39% (密度1.3g/cm3),则1L溶液中n(H2SO4)=$\frac{1000mL×1.3g/mL×39%}{98g/mol}$=5.17mol,所以剩余的n(H2SO4)=5.07mol,则浓度为5.07mol/L,
故答案为:Pb-2e-+SO42-=PbSO4;5.07;
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期.该元素可与D形成ED2和ED3两种化合物,则E为Fe元素,将Fe浸入到FeCl3中,发生反应为Fe+2Fe3+=3Fe2+,溶液由黄色逐渐变为浅绿色,
故答案为:Fe+2Fe3+=3Fe2+;
(4)石墨--铁在氯化铁电解质溶液中形成原电池,铁做负极,发生反应为Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+.
点评 本题考查元素推断和电化学知识,考查较为综合,题目难度中等,注意正确推断元素的种类为解答该题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| B. | 乙醇和汽油都是可再生资源,应大力推广使用“乙醇汽油” | |
| C. | 加入明矾使海水中的盐分沉淀可以使海水淡化,解决“淡水供应危机” | |
| D. | 要尽快发现地球上的有用物质,加大开采速度,加快社会发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量的氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2 O | |
| C. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ | |
| D. | 纯碱溶液中通入二氧化碳:CO32-+CO2+H2O=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com