
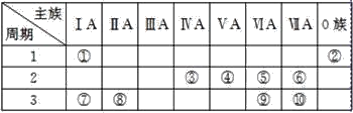
【题目】标号为①~⑩的元素,在元素周期表中的位置如图:
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是___(填写元素符号)。
(2)①和④号元素形成的化合物的化学式为___,用电子式表示其形成过程为___。
(3)⑧号元素的最高价氧化物的水化物的化学式是___。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是__,在该化合物中既含有___键,又含有____键。
【答案】H、F、Cl NH3 ![]() Mg(OH)2 Na+[
Mg(OH)2 Na+[![]()
![]()
![]() H]- 离子 极性共价
H]- 离子 极性共价
【解析】
由元素在周期表中位置,可知①为H、②为He、③为C、④为N、⑤为O、⑥为F、⑦为Na、⑧为Mg、⑨为S、⑩为Cl。
(1)其原子只要形成一对共用电子对就达到了稳定结构是H、F、Cl;
(2)①和④号元素形成的化合物为NH3,属于共价化合物,用N原子、H原子电子式表示其形成过程;
(3)⑧号元素的最高价氧化物的水化物为氢氧化镁;
(4)①、⑤、⑦号元素形成的一种化合物为NaOH,由钠离子与氢氧根离子构成,该化合物中含有离子键、共价键。
原子只要形成一对共用电子对就达到了稳定结构,说明该原子最外层可能只含1个电子或者含7个电子。①号元素是氢;④号元素是氮;⑤号元素是氧;⑦号元素是钠;⑧号元素为镁。
(1)其原子只要形成一对共用电子对就达到了稳定结构是H、F、Cl;故答案为:H、F、Cl;
(2)①和④号元素形成的化合物为NH3,属于共价化合物,用N原子、H原子电子式表示其形成过程![]() ;故答案为:NH3;
;故答案为:NH3;![]() ;
;
(3)⑧号元素的最高价氧化物的水化物为氢氧化镁;故答案为:Mg(OH)2;
(4)①、⑤、⑦号元素形成的一种化合物的电子式是Na+[![]()
![]()
![]() H]-;在该化合物中既含有离子键,又含有极性共价键,故答案为:Na+[
H]-;在该化合物中既含有离子键,又含有极性共价键,故答案为:Na+[![]()
![]()
![]() H]-;离子;极性共价。
H]-;离子;极性共价。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】中科院上海硅酸盐研究所开发出基于硫化银(![]() )柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的
)柔性半导体的新型高性能无机柔性热电材料和器件,研究人员发现硒(Se)、碲(Te)元素固溶的![]() 薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
薄片经历1000次反复弯曲后,电导率几乎未发生变化,表明材料的性能受应力影响较小,可满足柔性可穿戴供电的要求。回答下列问题:
(1)Ag的核外电子排布式是![]() ,则Ag在元素周期表中的位置是____。下列关于
,则Ag在元素周期表中的位置是____。下列关于![]() 的电子排布式书写正确的是____(填标号)。
的电子排布式书写正确的是____(填标号)。
a.![]() b.
b.![]() c.
c.![]()
(2)乙硫醇(![]() )是一种含硫有机物,和醋酸银可发生下列反应:
)是一种含硫有机物,和醋酸银可发生下列反应:![]()
乙硫醇中S原子的杂化类型是______。乙酸中羧基碳原子的杂化类型是_____,乙酸中含有的![]() 键数:
键数:![]() 键数=_____。
键数=_____。
(3)Cu与Ag为同族元素,熔点:Cu________Ag(填“>”或“<”),原因是________________。
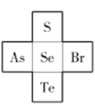
(4)S、Se、Te在元素周期表中与其他元素的位置关系如下图所示,则Te、As、Se、Br的第一电离能由大到小的顺序为________,![]() 的空间构型为________。
的空间构型为________。
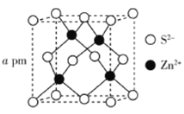
(5)ZnS的晶胞结构如下图所示,其密度为![]() ,晶胞边长
,晶胞边长![]() ________pm(用含
________pm(用含![]() 、
、![]() 的代数式表示,
的代数式表示,![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)![]() 2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是______%(保留整数)。
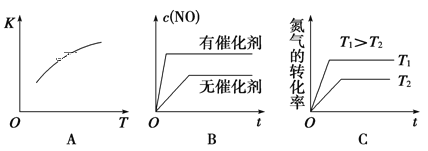
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应__________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 _______。将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 ________(填字母序号)。
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______(填“变大、“变小”或“不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。
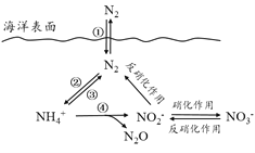
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮 b.海洋中的氮循环起始于氮的氧化c.海洋中的反硝化作用一定有氧气的参与d.向海洋排放含![]() 的废水会影响海洋中
的废水会影响海洋中![]() 的含量
的含量
(3)有氧时,在硝化细菌作用下,![]() 可实现过程④的转化,将过程④的离子方程式补充完整:___
可实现过程④的转化,将过程④的离子方程式补充完整:___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含多糖(淀粉)的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
![]()
![]()
![]() →
→![]() →
→![]() →
→![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)C中官能团的名称是______________________。
(2)B→C的反应类型是________________(填字母)。
A.取代反应 B.加成反应
C.氧化反应 D.还原反应
(3)写出由醋酸制备醋酸甲酯的化学反应方程式:
_______________________________________________________________________________。
(4)实验室由B可制备乙烯气体,写出将乙烯气体通入溴水中出现的现象:
_______________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
Ⅰ.化学上采用![]() 处理
处理![]() 不仅可以消除污染,还可作为工业生产的能量来源。
不仅可以消除污染,还可作为工业生产的能量来源。
(1)工业上可采用![]() 的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
的方法合成氨。我国学者采用量子力学方法,通过计算机模拟,研究了在催化剂表面上合成氨的反应历程。图1为各步反应的能量变化示意图,其中“吸”表示各气态物质在催化剂表面吸附。
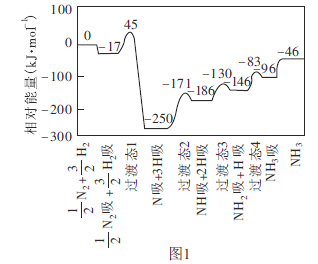
①该反应历程中正反应的最大活化能为________![]() 。
。
②合成氨反应的热化学方程式为_________________。
(2)不同温度下,向三个容器中分别投入相同量的反应物进行反应,测得不同压强下平衡混合物中![]() 的物质的量分数如图2所示。
的物质的量分数如图2所示。
①M点的![]() ________N点的
________N点的![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
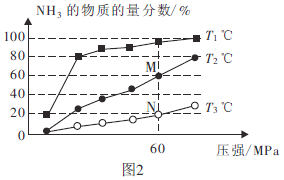
②![]() ℃时,将
℃时,将![]()
![]() 和
和![]()
![]() 充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________
充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,化学平衡常数K=________![]() (用最简分数表示)。
(用最简分数表示)。
Ⅱ.废水中的氮常以含氮有机物、氨、硝酸盐及亚硝酸盐等形式存在。
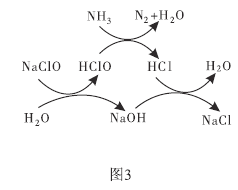
(3)①用次氯酸钠除去氨氮(以![]() 示)的原理如图3所示。写出总反应的化学方程式:______________。
示)的原理如图3所示。写出总反应的化学方程式:______________。
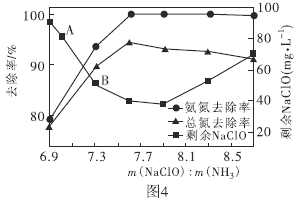
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应相同时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随![]() 的变化情况如图4所示。当
的变化情况如图4所示。当![]() 时,水体中总氮去除率反而下降,可能的原因是________。
时,水体中总氮去除率反而下降,可能的原因是________。
(4)近年来,水体中的硝酸盐含量不断增加。工业上去除废水中硝酸盐的方法是采用电解法将![]() 转化为
转化为![]() ,部分装置如图5所示。
,部分装置如图5所示。
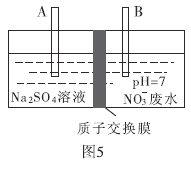
①B电极的电极反应式是________.
②常温下,除去10L废水中的![]()
![]() 后,最终废水的
后,最终废水的![]() ________(电解前后废水的体积变化忽略不计)。
________(电解前后废水的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
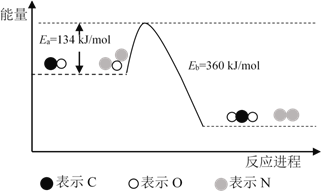
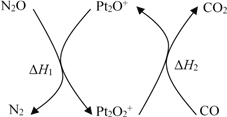
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com