
| A. | 50mL 1mol•L-1 NaCl溶液 | B. | 20mL 2mol•L-1 AlCl3溶液 | ||
| C. | 30mL 1mol•L-1 MgCl2溶液 | D. | 100mL 3mol•L-1 NaClO3溶液 |
分析 根据n=cV计算出该溶液中氯离子的物质的量,再根据c=$\frac{n}{V}$计算出混合液中氯离子的物质的量浓度;注意NaClO3溶液中不存在氯离子,据此对各选项进行判断.
解答 解:1L 0.1mol•L-1 NaCl溶液中含有氯离子的物质的量为:0.1mol/L×1L=0.1mol,
A.50mL 1mol•L-1 NaCl溶液中含有氯离子的物质的量为:1mol/L×0.05L=0.05mol,混合液体积为1.05L,混合液中氯离子的浓度为:$\frac{0.1mol+0.05mol}{1.05L}$=1.42mol/L;
B.20mL 2mol•L-1 AlCl3溶液中氯离子的物质的量为:2mol/L×3×0.02L=0.12mol,混合液体积为1.02L,混合液中氯离子的浓度为:$\frac{0.12mol+0.1mol}{1.02L}$=0.216mol/L;
C.30mL 1mol•L-1 MgCl2溶液中,氯离子的物质的量为:1mol/L×2×0.03L=0.06mol,混合液体积为1.03L,混合液中氯离子的浓度为:$\frac{0.06mol+0.1mol}{1.03L}$=0.155mol/L;
D.100mL 3mol•L-1 NaClO3溶液中不存在氯离子,则混合液中氯离子的物质的量为0.1mol,混合液中氯离子浓度为:$\frac{0.1mol}{1.1L}$=0.09mol/L;
根据分析可知,氯离子浓度最大的为B,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的表达式及计算方法为解答关键,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷与正丁烷的一氯取代产物的种类相同 | |
| B. | 分子式为C4H8O2且含 基团的同分异构体共有4种 基团的同分异构体共有4种 | |
| C. | 与CH2═CHCH3与HCl发生加成反应可得到2种有机物 | |
| D. | 分子式C8H10的苯的同系物共有3种结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
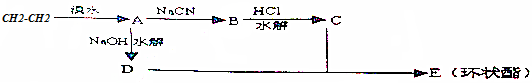
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液可由等体积、浓度均为0.1mol•L-1的醋酸和氨水反应得到 | |
| B. | CH3COONH4加人纯水中,水的电离程度不变 | |
| C. | 常温下,电离平衡常数K(CH3COOH)=K(NH3•H2O) | |
| D. | 该溶液中c(CH3COO-)大于同浓度CH3COONa溶液中的c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
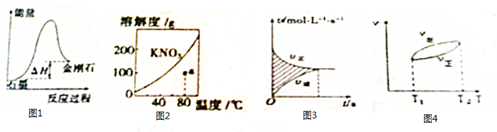
| A. | 由图1可知,从能量角度考虑,金刚石比石墨更稳定 | |
| B. | 图2中a点降温后加入KNO3 固体都能转变成饱和溶液 | |
| C. | 图3中阴影部分的面积表示△v=v正-v逆 | |
| D. | 由图4可知,正反应△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
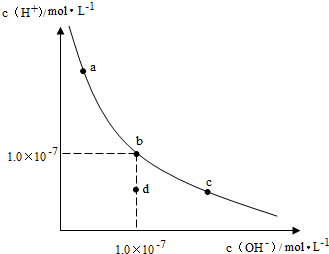
| A. | 升高温度,可能引起由c向b的变化 | |
| B. | 该温度下,水的离子积常数为1.0×10-13 | |
| C. | 该温度下,加入FeCl3可能引起由b向a的变化 | |
| D. | 该温度下,稀释溶液可能引起由c向d的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
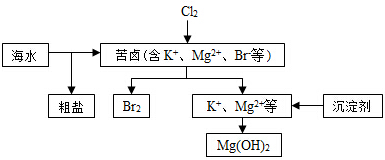
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂和重结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | 元素X、Z、W的最高化合价分别与其主族序数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com