
| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
分析 A.“臭氧空洞”与氟氯烃污染有关,温室效应与二氧化碳有关,两者与氮氧化物无关;
B.物理变化和化学变化的根本区别在于是否有新物质生成;
C.“低碳经济”指的是生活作息时所耗用的能量要尽量减少,特别是减少二氧化碳的排放量,减缓生态恶化;
D.胶体具有丁达尔效应,溶液没有丁达尔效应.
解答 解:A.“光化学烟雾”的形成、“硝酸型酸雨”的形成与氮的氧化物有关,但“臭氧空洞”与氟氯烃污染有关,“温室效应”与二氧化碳有关,故A错误;
B.石油裂解是石油化工生产过程中,以比裂化更高的温度(700℃~800℃,有时甚至高达1000℃以上),使石油分馏产物(包括石油气)中的长链烃断裂成乙烯、丙烯等短链烃的加工过程,属于化学变化;煤的气化是煤与碳反应生成一氧化碳和氢气,属于化学变化;海水制镁由镁离子生成镁单质;以上过程中都有新物质生成,包含化学变化,但石油中提取石蜡,是从石油分馏得到的重烃,无新物质生成,故B错误;
C.低碳经济是指在可持续发展理念指导下,通过技术创新、制度创新、产业转型、新能源开发等多种手段,尽可能地减少煤炭石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态,故C正确;
D.氢氧化铁胶体具有丁达尔效应,氯化铁溶液没有丁达尔效应,可以用丁达尔效应鉴别,故D正确.
故选:AB.
点评 本题考查常见的环境污染、煤和石油加工、胶体性质等,注意把握物物的性质、用途,题目有利于培养学生良好的科学素养,题目难度不大.


科目:高中化学 来源: 题型:解答题
 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
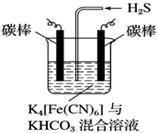
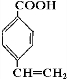 .
.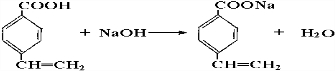 .
.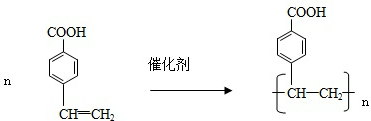 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 联碱法对母液的处理方法是向母液中通入二氧化碳,冰冻和加食盐 | |
| B. | 列管式热交换器的使用实现了原料的充分利用 | |
| C. | 焙烧辰砂制取汞的反应原理为:HgS+O2$\stackrel{焙烧}{→}$Hg+SO2 | |
| D. | 氯碱工业、铝的冶炼、牺牲阳极的阴极保护法都是应用了电解池的原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
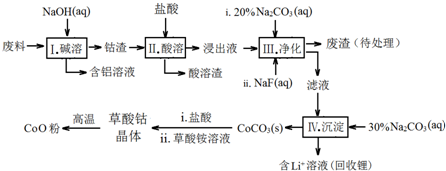
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
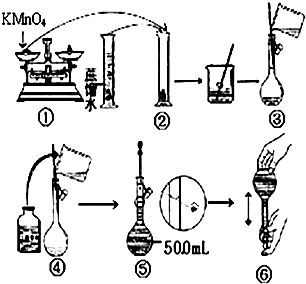 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
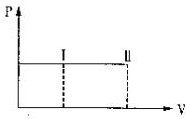 一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.
一带有活塞的密封容器中盛有A、B组成的混合气体,在通常条件下,从状态I反应到状态II时,气体体积(V)与气体压强(P)的变化曲线如图所示.| A. | 是放热反应 | |
| B. | 反应后气体总分子数增多 | |
| C. | 是吸热反应 | |
| D. | 反应物具有的总能量等于生成物具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
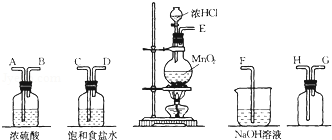
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com