
判断下列热化学方程式书写是否正确,正确的划“√”,错误的划“×”(注:焓变数据均正确)
(1)CaCO3(s)===CaO+CO2(g) ΔH=+177.7 kJ( )
(2)C(s)+H2O(s)===CO(g)+H2(g) ΔH=-131.3 kJ·mol-1( )
(3)C(s)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1( )
(4)CO(g)+ O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1( )
(5)2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1( )
(6)500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热
19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1( )
2NH3(g) ΔH=-38.6 kJ·mol-1( )
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。
[方案一]
[实验方案] 将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_____________________________。
[实验步骤]
(1)称取10.8 g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0 mol·L-1的NaOH溶液中,充分反应。则NaOH溶液的体积V≥__________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______________(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案] 将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用下列实验装置完成实验:

你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。

(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测
氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管a的作用是_______________________________________________;
②实验前后量气管中液面读数分别为V1 mL、V2 mL,则产生氢气的体积为__________mL;
③若需确定产生氢气的量,还需测定的数据是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。

①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________ mol;用平衡移动原理解释阴极区pH增大的原因:________________________________________________________________________
________________________________________________________________________。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为______________________________________________
________________________________________________________________________。
若以该电池为电源,用石墨作电极电解100 mL含有以下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64 kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2 mol SO2、1 mol O2,达到平衡时放出热量为Q1 kJ,在同样条件下,向该容器中通入2 mol SO3,达到平衡时,吸收热量为Q2 kJ,则Q1和Q2的关系为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)S(s)+ O2(g)===SO3(g) ΔH=-315 kJ·mol-1(燃烧热) (ΔH的数值正确)( )
O2(g)===SO3(g) ΔH=-315 kJ·mol-1(燃烧热) (ΔH的数值正确)( )
(2)NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=-57.3 kJ·mol-1(中和热) (ΔH的数值正确)( )
(3)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1( )
(4)燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+ O2(g)===CO2(g)+2H2(g)
O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1( )
(5)H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1( )
(6)葡萄糖的燃烧热是2 800 kJ·mol-1,则 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1( )
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1( )
(7)已知101 kPa时,2C(s)+O2(g)===2CO(g)
ΔH=-221 kJ·mol-1,则该反应的反应热为221 kJ·mol-1( )
(8)已知稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol水时放出57.3 kJ的热量( )
(9)已知HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1 mol水的中和热为-57.3 kJ·mol-1( )
(10)CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1( )
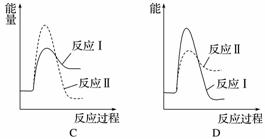
(11)氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)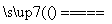 2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1( )
2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1( )
查看答案和解析>>
科目:高中化学 来源: 题型:
LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1 065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是__________________________。
(2)[2014·浙江理综,27(3)]煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)??CaO(s)+SO2(g)+CO2(g)
ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)??CaS(s)+4CO2(g)
ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
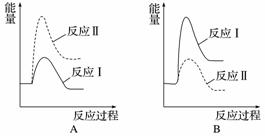
(3)[2014·广东理综,31(1)]用CaSO4代替O2与燃料CO反应,既可提高燃料效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)??1/4CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g)??CaO(s)+CO2(g)+SO2(g)
ΔH2=+210.5 kJ·mol-1
③CO(g)??1/2C(s)+1/2CO2(g)
ΔH3=-86.2 kJ·mol-1
反应2CaSO4(s)+7CO(g)??CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的ΔH=__________(用ΔH1、ΔH2和ΔH3表示)。
(4)[2014·大纲全国卷,28(1)]化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为____________________________________。
(5)[2014·天津理综,7(4)]晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
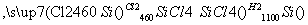
写出SiCl4的电子式:______;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com