
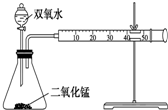
 某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:| MnO2 时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
| △c |
| △t |


科目:高中化学 来源: 题型:
| A、2C6H5CH2CH3(g)+O2(g)?2C6H5CH=CH2(g)+2H2O(g)△H<0 |
| B、CO2(g)+H2(g)?CO(g)+H2O(g)△H>0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g)△H>0 |
| D、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于6.7 | B、小于6.7 |
| C、等于6.7 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| A | B | C | |||
| 1 | 35 | 2 | 4 | 1.6 | 5 |
| 2 | 60 | 1 | 2 | 0.4 | 3 |
| 3 | 60 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.
镁在空气中燃烧除生成MgO外,还可能生成Mg3N2.某校化学兴趣小组的同学利用镁在空气中燃烧后的固体(不含单质)进行实验,探究其组成.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6mol |
| B、1mol |
| C、0.8mol |
| D、1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16.7% | B、50% |
| C、66.7% | D、83.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Mg+CO2
| ||||
| B、Mg(OH)2+2HCl=MgCl2+2H2O | ||||
C、2Al+Fe2O3
| ||||
D、H2+CuO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com