
| cCO2?cH2 |
| cCO?cH2O |
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A、若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态 | ||||
| B、上述反应的正反应是放热反应 | ||||
| C、该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | ||||
D、若平衡浓度符合下列关系式:
|
| 0.4×0.4 |
| 0.6×0.6 |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 3 |
| 5 |
| c(CO2) |
| 3c(CO) |
| c(H2O) |
| 5c(H2) |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A、若升高温度,反应的平衡常数减小,则正反应为吸热 |
| B、反应5min内,v(PCl3)=0.08 mol?L-1?min-1 |
| C、当容器中Cl2为1.2mol时,可逆反应达到平衡状态 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去.常温常压下,A是红棕色金属氧化物,B、D和L都是生产生活中常见的金属单质,B元素是地壳中含量最多的金属元素,F和J为常见的非金属元素的气体单质,且F呈无色、J呈黄绿色,L单质呈紫红色,E和M都是典型的两性化合物;C是氯碱工业的主要产品之一,俗名烧碱;C与K在溶液中反应时有红褐色沉淀生成.
如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去.常温常压下,A是红棕色金属氧化物,B、D和L都是生产生活中常见的金属单质,B元素是地壳中含量最多的金属元素,F和J为常见的非金属元素的气体单质,且F呈无色、J呈黄绿色,L单质呈紫红色,E和M都是典型的两性化合物;C是氯碱工业的主要产品之一,俗名烧碱;C与K在溶液中反应时有红褐色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:
 金属单质A和非金属单质B、C及甲、乙、丙、丁、戊五种化合物有如图所示的转化关系,甲是工业上冶炼A的主要原料,丙是一种无色无味的液体.请回答:
金属单质A和非金属单质B、C及甲、乙、丙、丁、戊五种化合物有如图所示的转化关系,甲是工业上冶炼A的主要原料,丙是一种无色无味的液体.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、向氯水中加入少量NaHCO3可以增大氯水中次氯酸的浓度 |
| D、NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )的合成路线如下:
)的合成路线如下: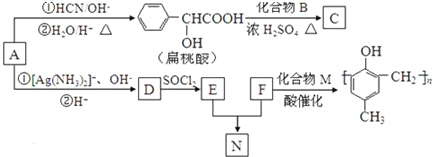
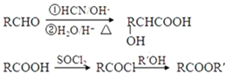 ,F分子式为C7H8O,
,F分子式为C7H8O,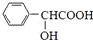 )有多种同分异构体,其中满足下述条件的同分异构体有
)有多种同分异构体,其中满足下述条件的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B和C都是固体 |
| B、B和C一定都是气体 |
| C、B和C可能都是气体 |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L的NaCl溶液中含溶质1mol |
| B、常温常压下,17g氨气所含电子数为10NA |
| C、2.24L氮气所含的原子数为0.2NA |
| D、1molFeCl3形成的氢氧化铁胶体中含有NA个胶粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com