

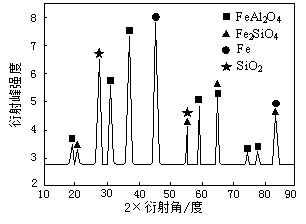
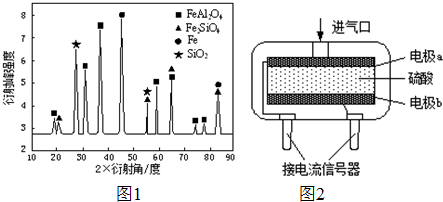
| 2×①+② |
| 3 |
| 2a+b |
| 3 |
| 2a+b |
| 3 |
| ||
| 5.3mol |
| 106g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
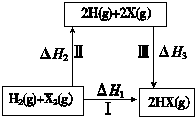 关于如图所示转化关系(X代表卤素),说法不正确的是( )
关于如图所示转化关系(X代表卤素),说法不正确的是( )| A、2H(g)+2X(g)═2HX(g)△H3<0 |
| B、途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 |
| C、Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
| D、途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 |
| B、在汽车排气管上加装“催化转化器”是为了减少有害气体的排放 |
| C、硬铝属于合金材料,瓷器属于硅酸盐制品 |
| D、食醋可去除水垢,NH4Cl溶液可去除铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
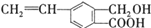 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )| A、有机物M的分子式为C10H12O3 |
| B、1mol Na2CO3最多能消耗1mol有机物M |
| C、1mol M和足量金属钠反应生成22.4L气体 |
| D、有机物M能发生取代、氧化和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
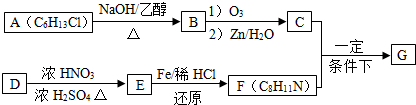
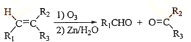

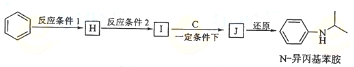
查看答案和解析>>
科目:高中化学 来源: 题型:
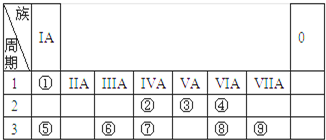
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.24 mol |
| B、0.21 mol |
| C、0.25 mol |
| D、0.14 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com