
【题目】聚合物 ![]() (W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图:
(W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图: 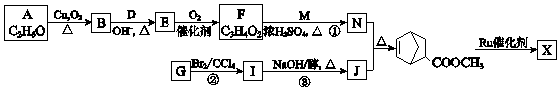
已知:
i.R1CHO+R2CH2CHO ![]()
![]()
ii. ![]()
iii.R1CH=CHR2+R3CH=CHR4 ![]() R1CH=CHR4+R3CH=CHR2
R1CH=CHR4+R3CH=CHR2
(R代表烃基或氢原子)
(1)A的结构简式是 .
(2)B所含的官能团名称是 .
(3)E的结构简式是 .
(4)①的化学方程式是 .
(5)②的反应类型是 .
(6)J是五元环状化合物,③的化学方程式是 .
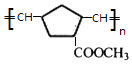
(7)X的结构简式是 .
【答案】
(1)CH3CH2OH
(2)醛基
(3)CH2=CHCHO
(4)CH2=CHCOOH+CH3OH ![]() CH2=CHCOOCH3+H2O
CH2=CHCOOCH3+H2O
(5)加成反应
(6)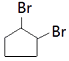 +2NaOH
+2NaOH ![]()
![]() +2 NaBr+2 H2O
+2 NaBr+2 H2O
(7)
【解析】解:A发生催化氧化反应生成B,B和D发生信息i的反应生成E,结合A的分子式知,A结构简式为CH3CH2OH,B为CH3CHO,E发生氧化反应生成F,根据F分子式知,D为HCHO,E为CH2=CHCHO,F为CH2=CHCOOH.N与J发生信息ii中的反应,结合产物结构简式可知N、J分别为CH2=CHCOOCH3、 ![]() 中的一种,结合F的结构简式可知N为CH2=CHCOOCH3、J为
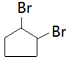
中的一种,结合F的结构简式可知N为CH2=CHCOOCH3、J为 ![]() ,故M为CH3OH.I发生消去反应生成J,G发生加成反应生成I,则G、I结构简式分别为
,故M为CH3OH.I发生消去反应生成J,G发生加成反应生成I,则G、I结构简式分别为 ![]() 、
、  .由信息iii可知
.由信息iii可知 ![]() 在Ro催化剂条件下生成聚合物X为
在Ro催化剂条件下生成聚合物X为 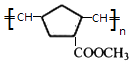 .(1)由上述分析可知,A的结构简式是 CH3CH2OH,所以答案是:CH3CH2OH;(2)B为CH3CHO,所含的官能团名称是醛基,所以答案是:醛基;(3)由上述分析可知,E的结构简式是CH2=CHCHO,所以答案是:CH2=CHCHO;(4)①的化学方程式是:CH2=CHCOOH+CH3OH
.(1)由上述分析可知,A的结构简式是 CH3CH2OH,所以答案是:CH3CH2OH;(2)B为CH3CHO,所含的官能团名称是醛基,所以答案是:醛基;(3)由上述分析可知,E的结构简式是CH2=CHCHO,所以答案是:CH2=CHCHO;(4)①的化学方程式是:CH2=CHCOOH+CH3OH ![]() CH2=CHCOOCH3+H2O,所以答案是:CH2=CHCOOH+CH3OH
CH2=CHCOOCH3+H2O,所以答案是:CH2=CHCOOH+CH3OH ![]() CH2=CHCOOCH3+H2O;(5)②是
CH2=CHCOOCH3+H2O;(5)②是 ![]() 与溴发生加成反应生成
与溴发生加成反应生成  ,所以答案是:加成反应;(6)③的化学方程式是:
,所以答案是:加成反应;(6)③的化学方程式是:  +2NaOH
+2NaOH ![]()
![]() +2 NaBr+2 H2O,所以答案是:
+2 NaBr+2 H2O,所以答案是:  +2NaOH
+2NaOH ![]()
![]() +2 NaBr+2 H2O;(7)由信息iii可知
+2 NaBr+2 H2O;(7)由信息iii可知 ![]() 在Ro催化剂条件下生成聚合物X为
在Ro催化剂条件下生成聚合物X为 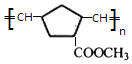 ,所以答案是:
,所以答案是:  .
.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( ) 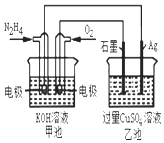
A.甲池中负极反应为:N2H4﹣4e﹣═N2+4H+
B.甲池溶液pH不变,乙池溶液pH减小
C.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗2.24L O2 , 此时乙池中理论上最多产生12.8g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则将这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性.物质有光学活性,它发生下列反应后生成的有机物仍有光学活性的是( ) 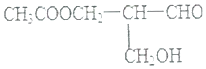
A.与NaOH溶液共热
B.与甲酸发生酯化反应
C.与碱性Cu(OH)2悬浊液反应
D.在催化剂存在下与H2作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置(夹持装置略)制取和收集纯净、干燥的氨气,并探究 氨气的性质。
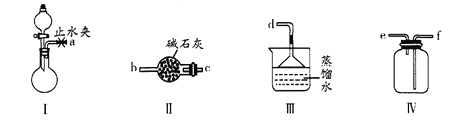
(1)关闭装置I中的止水夹,向分液漏斗中加入适量水,打开活塞,说明装置I 气密性良好的现象是____________________________________________________。
(2)利用装置I制取氨气,应选用的试剂为浓氨水_______ 和 ______(填序号)。
A.氢氯化钠 B.浓硫酸 C.硝酸钾 D.生石灰
(3)根据实验要求,仪器连接的顺序(用字母编号表示):a接_____, 接 , 接 。
(4)将氨气通入盛有氧化铜粉末的玻璃管中,加热有红色固体和无色气体单质生成,证明氨气具有_____________性,反应的化学方程式是__________________________________。
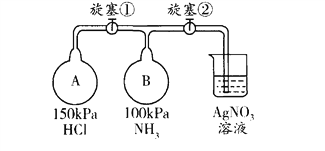
(5)收集氨气,按下图玻璃装置进行实验。先打开旋塞①,B瓶中产生白色的烟,原因是______________________ (用化学方程式表示);稳定后,关闭旋塞①,再打幵旋塞②,B瓶中的现象是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2Fe3++2I﹣2Fe2++I2 , 用KI溶液和FeCl3溶液进行如下实验.下列说法中,不正确的是( ) 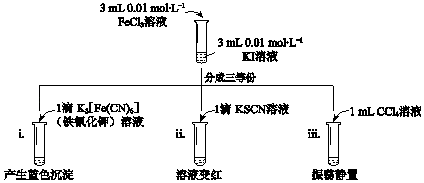
A.实验i中现象说明有Fe2+生成
B.实验ii中现象说明反应后溶液中含有Fe3+
C.实验iii水溶液中c(Fe2+)大于i中c(Fe2+)
D.实验iii中再加入4滴0.1 molL﹣1 FeCl2溶液,振荡静置,CCl4层溶液颜色无变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4 , 其过程如下: I. 向软锰矿浆中通入SO2 , 锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2.
II. 向浸出液中加MnO2 , 充分反应后,加入石灰乳,调溶液pH=4.7.
III.再加入阳离子吸附剂,静置后过滤.
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体.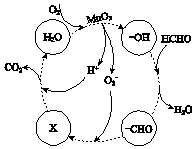
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4 , 该反应的化学方程式是 .
(2)II 中加入MnO2的主要目的是;调溶液 pH=4.7,生成的沉淀主要含有 和少量CaSO4 .
(3)III中加入阳离子吸附剂,主要除去的离子是 .
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2 . ①电解MnSO4溶液的离子方程式是
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如图所示,其中X是 , 总反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HCl(aq)、Al(OH)3、NaOH(aq)、Al、Cl2、Al2O3六种物质,它们之间的关系如图所示,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是
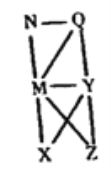
A. M一定为NaOH(aq) B. Z可能为Al2O3
C. N可能为Cl2、Al、Al2O3、Al(OH)3中的一种 D. Y一定是HCl(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性实验小组欲验证浓硝酸在与Cu、Ag 合金的反应过程中除生成NO2气体外,还会有少量NO生成。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装器。
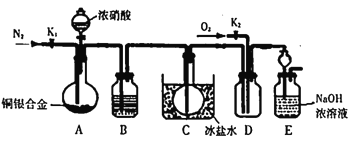
请回答下列问题
(1)写出A中银与HNO3反应时所有可能的离子方程式_____________________。
(2)实验开始时,打开分液漏斗前要先打开活塞______( 填“K1”或“K2”),其目的是___________。
(3)装置中B瓶选用的试剂______________。
a.H2O b.浓硫酸 c.NaOH 熔液
(4)装置E中长颈漏斗的作用____________。
(5)反应停止后,欲想证明有NO生成,需要怎样操作:__________,当出现何种现象说明有NO生成____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
A. 实验室制乙烯
实验室制乙烯
B.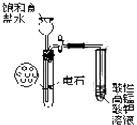 实验室制乙炔并验证乙炔发生氧化反应
实验室制乙炔并验证乙炔发生氧化反应
C.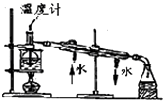 实验室中分馏石油
实验室中分馏石油
D.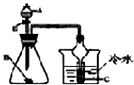 若A为醋酸,B为贝壳(粉状),C为苯酚钠溶液,验证醋酸、苯酚、碳酸酸性的强弱(不考虑醋酸的挥发)
若A为醋酸,B为贝壳(粉状),C为苯酚钠溶液,验证醋酸、苯酚、碳酸酸性的强弱(不考虑醋酸的挥发)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com