

| ||
| ||
| ||


科目:高中化学 来源: 题型:
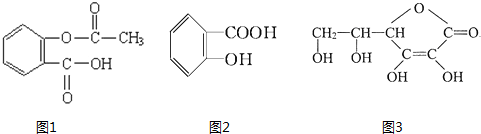
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 75℃ | - | - | 1mL | 100s |
| 2 | 75℃ | 10滴 | - | 1mL | 40s |
| 3 | 75℃ | 10滴 | 加入少许 | 1mL | 3s |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入足量,将产生的气体通入 . | |
| 步骤2:向步骤1得到的溶液中滴加几滴. |
查看答案和解析>>
科目:高中化学 来源: 题型:
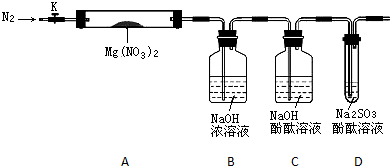
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
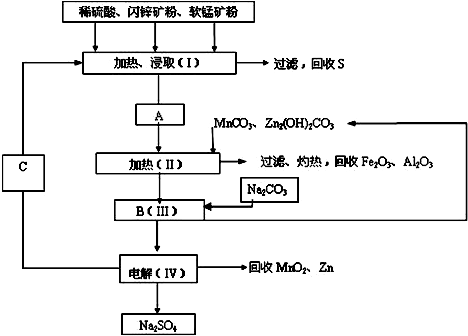
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定不含Fe3+和Fe2+ |
| B、溶液可能含有AlO2- |
| C、溶液可能含有NO3- |
| D、可能含有Fe3+但一定不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
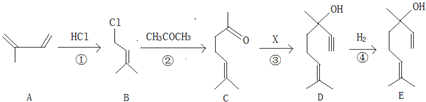
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com