
| A. | 晶体硅可用于制造光导纤维 | B. | 氯氧化钠用来治疗胃酸过多 | ||
| C. | 铝制容器可以用来贮运稀硝酸 | D. | 乙烯用作水果的催熟剂 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠能置换出水中所有的氢,却只能置换出乙醇里羟基中的氢 | |
| B. | 钠都要浮在水面上或乙醇液体表面 | |
| C. | 钠无论与水反应还是与乙醇反应都要放出热量 | |
| D. | 钠在乙醇中反应更剧烈,是因为乙醇分子中含有的氢原子比水分子中的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH${\;}_{4}^{+}$ | B. | Mg2+ | C. | Fe2+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应中转移的电子为n mol,则n一定大于0.15 mol | |
| B. | n(NaCl):n(NaClO):n(NaClO3)可能为7:2:1 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(Na+):n(Cl-) 可能为7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| C. | 用氨水溶液氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H20 | |
| D. | Fe(OH)3 溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
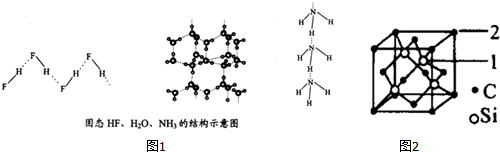
| 物质 | 氢键X-H…Y | 键能KJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
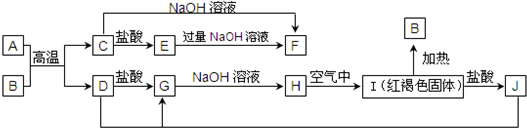
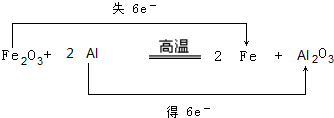 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com