
| A. | 铁在熔融状态下能导电,所以铁是电解质 | |
| B. | 氯化氢在熔融状态下不导电,所以氯化氢是非电解质 | |
| C. | 氯气的水溶液能导电,所以氯气是电解质 | |
| D. | 电解质和非电解质都是纯净物 |
分析 A、在水溶液中或熔融状态下能导电的化合物为电解质;
B、HCl溶于水后能电离出自由移动的离子;
C、电解质必须是化合物;
D、在水溶液中或熔融状态下能导电的化合物为电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质.
解答 解:A、在水溶液中或熔融状态下能导电的化合物为电解质,而铁是单质,故不是电解质,故A错误;
B、HCl虽然在熔融状态下不导电,但溶于水后能电离出自由移动的离子而导电,故是电解质,故B错误;
C、电解质必须是化合物,而氯气是单质,故不是电解质,故C错误;
D、在水溶液中或熔融状态下能导电的化合物为电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质,故电解质和非电解质必须是化合物,而化合物一定是纯净物,故电解质和非电解质都是纯净物,故D正确.
故选D.
点评 本题考查了电解质和非电解质的概念,应注意的是电解质和非电解质一定是化合物,单质和混合物既不是电解质也不是非电解质.


科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
Ⅰ.已知:Na2S2O3+H2SO4==Na2SO4+SO2↑+S ↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
↓+H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度 | Na2S2O3浓度[ | 稀硫酸 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究 对反应速率的影响,因此V1、V2和V3分别是 、 、 。
(2)实验①、③可探究 对反应速率的影响,因此V4、V5分别是 、 。
Ⅱ.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。如图中的曲线表示二氧化氮分解反应在前25秒内的反应进程。
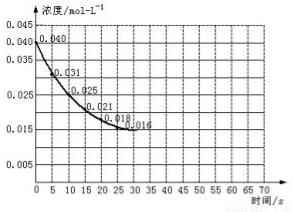
(3)前20秒内氧气的平均生成速率 mol/(L·s)
(4)在某温度下达到平衡时的平衡常数表达式是 。
(5)在某温度下达到平衡后,不改变其它条件,向该容器中再加入少量的NO2,平衡移动的方向是 ,NO2的平衡转化率 68.75%(填“>”、“<”或“=”),NO的体积百分含量 (填“增大”、“减小”或“不变”)。
(6)若在反应开始时加入催化剂(其他条件都不变),反应经过20秒达到平衡,请在图上用虚线画出加催化剂后反应0~70s的曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 几种物质都有 | B. | 有甲酸乙酯,可能有甲酸 | ||
| C. | 有甲酸乙酯和甲醇 | D. | 有甲酸乙酯,可能有甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NH3(g)+5O2(g)═4 NO(g)+6 H2O(g)△H=+a kJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-b kJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-c kJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(g)△H=-d kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究含氮、硫污染物的治理是环保的一项重要工作.
研究含氮、硫污染物的治理是环保的一项重要工作.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑦⑧⑨ | B. | ②④⑥⑦⑧⑨ | C. | ①④⑥⑧ | D. | ①②④⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑥⑦ | C. | ④⑦ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径由大到小的顺序:Z、X、Y | |
| B. | 元素非金属性由强到弱的顺序:W、Z、Y | |
| C. | 简单气态氢化物的稳定性强弱顺序:Z>W | |
| D. | W分别与X、Y形成的化合物化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用煤的液化、气化技术,可有效防治雾霾天气 | |
| B. | 氢氟酸可在玻璃器皿上刻蚀标记 | |
| C. | 高温、紫外线或“84”消毒液均可用于杀菌消毒 | |
| D. | 纯碱可以去除油污是因为Na2CO3可直接与油污反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com