
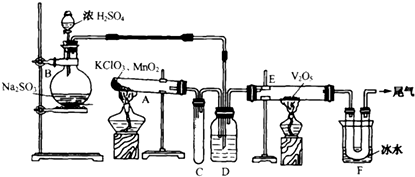
分析 (1)二氧化硫与氧气在催化剂作用下反应生成三氧化硫;
(2)小试管C起安全瓶的作用防止倒吸;
(3)广口瓶中盛放浓硫酸,可以干燥气体,同时使SO2和O2两种气体混合均匀,控制气体的比例和流速;
(4)依据可逆反应不能进行到底的特点解答;
(5)依据三氧化硫物理性质解答;
(6)若U形管内收集到的物质很少的原因可能是漏气、生成气体流速过快,过程中不能生成硫化氢;
(7)剩余二氧化硫气体有毒污染空气,需要用碱溶液吸收.
解答 解:(1)二氧化硫与氧气在催化剂作用下反应生成三氧化硫,方程式:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
故答案为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
(2)小试管C起安全瓶的作用防止倒吸;
故答案为:防止倒吸;
(3)广口瓶中盛放浓硫酸的三个作用为:①干燥气体,②使SO2和O2两种气体混合均匀③控制气体的比例和流速;
故答案为:①干燥气体,②使SO2和O2两种气体混合均匀③控制气体的比例和流速;
(4)二氧化硫与氧气反应生成三氧化硫为可逆反应,不能进行到底,所以反应后气体含有SO3、SO2、O2;
故答案为:SO3、SO2、O2;
(5)三氧化硫为无色固体,所以装置F中U形管观察到所收集物质的颜色状态为无色固体;
故答案为:无色固体;
(6)若U形管内收集到的物质很少的原因可能是a装置气密性不好,c气流速度过快,过程中无法制得H2S杂质,b不可能,
故答案为:b;
(7)剩余二氧化硫气体有毒污染空气,需要用碱溶液吸收,SO2+2NaOH=Na2SO3+H2O,
故答案为:应用NaOH溶液吸收.
点评 本题考查了三氧化硫的制备,明确二氧化硫、氧气的制备原理,明确二氧化硫与氧气反应为可逆反应特点是解题关键,注意装置作用分析、物质性质的记忆,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S溶液中只存在2个电离平衡 | |
| B. | c(OH-)=$\sqrt{{K}_{w}}$的溶液一定呈中性 | |
| C. | 加热碳酸钠溶液可证明其水解是吸热反应 | |
| D. | 常温下,在AlPO4和FePO4的饱和溶液中滴加少量Na3PO4溶液,Ksp(AlPO4)和Ksp(FePO4)将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L乙醇中碳氢键的数目为0.5 NA | |
| B. | 1 L 0.1 mol•L-1硫酸钠溶液中含有的氧原子数为0.4 NA | |
| C. | 0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1 NA | |
| D. | 0.1 mol乙烯与乙醇的混合物完全燃烧所消耗的氧分子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
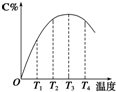 可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.
可逆反应A(g)+B(g)?2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 1760℃ | 2400℃ | 2730℃ |
| 平衡常数 | 2.4×10-4 | 6.4×10-3 | 8.9×10-3 |
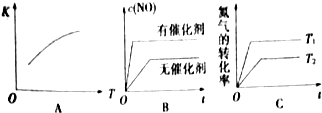
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com