
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)
 4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是( )
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的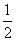 ,则再次平衡时c(N2O5)>5.00 mol·L-1
,则再次平衡时c(N2O5)>5.00 mol·L-1
C [解析] 500 s内N2O4的分解速率为
v(N2O5)=(5.00 mol·L-1-3.52 mol·L-1)÷500 s=2.96×10-3mol·L-1·s-1,A项正确;
2N2O5(g)
 4NO2(g)+O2(g)
4NO2(g)+O2(g)
起始浓度(mol·L-1):5.00 0 0
转化浓度(mol·L-1):2.50 5.00 1.25
平衡浓度(mol·L-1):2.50 5.00 1.25
N2O5的转化率为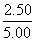 ×100%=50%,平衡常数K=
×100%=50%,平衡常数K=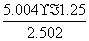 =125,B项正确;由于该反应是吸热反应,故温度升高平衡常数增大,C项错误;缩小体积,平衡逆向移动,N2O5浓度将大于原平衡的二倍,D项正确。
=125,B项正确;由于该反应是吸热反应,故温度升高平衡常数增大,C项错误;缩小体积,平衡逆向移动,N2O5浓度将大于原平衡的二倍,D项正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间 /min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O) (mol·L-1) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间 /min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O) (mol·L-1) | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
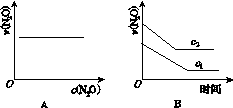
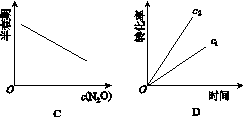
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间 /min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O) (mol·L-1) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间 /min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O) (mol·L-1) | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
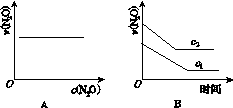
查看答案和解析>>
科目:高中化学 来源: 题型:
处于平衡状态的反应2H2S(g) 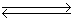 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下合理的说法是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下合理的说法是( )
A.加入催化剂,反应路径将发生改变,ΔH也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术。反应①为主反应,反应②和③为副反应。
①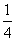 CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
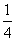 CaS(s)+CO2(g)
CaS(s)+CO2(g)
ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g)
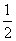 C(s)+
C(s)+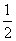 CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
(1)反应2CaSO4(s)+7CO(g) CaS(s)+CaO(s)+6CO2(g) +C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
CaS(s)+CaO(s)+6CO2(g) +C(s)+SO2(g)的ΔH=________(用ΔH1、ΔH2和ΔH3表示)。
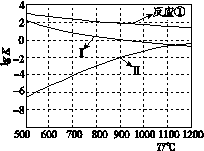
(2)反应①~③的平衡常数的对数lg K随反应温度T的变化曲线如图所示。结合各反应的ΔH,归纳lg K~T曲线变化规律:
a.________; b.________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900 ℃达到平衡,c平衡(CO)=8.0×10-5mol·L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为______________________________________,在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
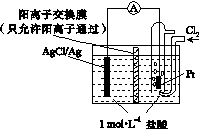
某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )
A.正极反应为AgCl+e-===Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列4种鉴别碳酸钠和碳酸氢钠的方法中,可靠性最差的是
A.观察样品外观 B.在少量的样品中滴入几滴水
C.在饱和溶液中滴入几滴酚酞 D.取少量的试样加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com