
 2Z��g��+W��g����H��0���ﵽƽ��ʱ��VA=1.2aL��������˵���������
2Z��g��+W��g����H��0���ﵽƽ��ʱ��VA=1.2aL��������˵���������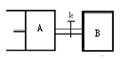
| A���٢ڢۢ� | B���٢ڢ� | C���ڢ� | D��ֻ�Т� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NO2�����������С | B��NO2��ת������� |
| C��NO2�������������� | D����Ӧ�ų�������������ԭ����2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cP��g������H=Q kJ��mol-1����Ӧ��ƽ��ʱ��P�����ʵ���Ũ�ȣ�mol��L-1��������������¶ȵĹ�ϵ���±������У�˵����ȷ���ǣ� ��
cP��g������H=Q kJ��mol-1����Ӧ��ƽ��ʱ��P�����ʵ���Ũ�ȣ�mol��L-1��������������¶ȵĹ�ϵ���±������У�˵����ȷ���ǣ� ��
  c��P�� c��P�� | 1 L | 2 L | 3 L | ||||
| 100�� | 1.30 | 1.00 | 0.70 | ||||
| 200�� | 1.20 | 0.90 | 0.62 | ||||
| 300�� | 1.00 | 0.75 | 0.53 |
| A��Q��0 |
| B���¶Ȳ��䣬�����������������Ӧ���������淴Ӧ���ʼ�С |
| C������������䣬�����¶ȣ�ƽ����ϵ��M������ٷֺ�����С |
| D��a+b��c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)(����ӦΪ���ȷ�Ӧ)�Ŀ��淴Ӧ���ں��������£�ƽ��ʱB�ڻ�����еĺ�����B%����ѹǿ�Ĺ�ϵ��ͼ2��32��ʵ����ʾ���й�������ȷ���� �� ��
pC(g)(����ӦΪ���ȷ�Ӧ)�Ŀ��淴Ӧ���ں��������£�ƽ��ʱB�ڻ�����еĺ�����B%����ѹǿ�Ĺ�ϵ��ͼ2��32��ʵ����ʾ���й�������ȷ���� �� ��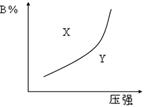
| A��m+n> p |
| B��x������ʹ�ϵΪv����v�� |
| C��n>p |
| D��x���y�����ﷴӦ���ʿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)+D(g)�Ѵ�ƽ��״̬����
C(g)+D(g)�Ѵ�ƽ��״̬����| A����������ѹǿ����ʱ��仯���仯 |
| B�����������ܶȲ���ʱ��仯���仯 |
| C�����������ʵ�������ʱ��仯���仯 |
| D����λʱ��������n mol C��ͬʱ����2n mol B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HI(g)�����������ܹ�˵����Ӧ�Ѵ�ƽ��״̬����
2HI(g)�����������ܹ�˵����Ӧ�Ѵ�ƽ��״̬����| A�������ʵ����ʵ���Ũ�ȱ�Ϊ1:1:2 | B��v(H2)��==v��HI���� |
| C������2mol H��I����ͬʱ����1mol I��I�� | D������������ɫ���ٱ仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3������Ӧ�ﵽƽ��ʱ���䷴Ӧ���ʿ��Էֱ���V��H2����V��N2����V��NH3����ʾ������ȷ�Ĺ�ϵʽ��
2NH3������Ӧ�ﵽƽ��ʱ���䷴Ӧ���ʿ��Էֱ���V��H2����V��N2����V��NH3����ʾ������ȷ�Ĺ�ϵʽ��| A��v(H2)="v(N2)=v(NH3)" | B��v(H2)=3v(N2) |
| C��v(NH3)="3(H2)" | D��v(N2)=3V(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ���ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ� ��
���ܱ������з�Ӧ���ﵽƽ��״̬�ı�־�ǣ� ��| A��NO2ȫ�������NO��O2 | B����Ӧ�Ѿ�ֹͣ�� |
C����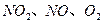 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬ �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬ | |
D����λʱ��������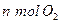 ��ͬʱ���� ��ͬʱ����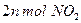 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������淴Ӧ�ﵽƽ��״̬ʱ��v��= v��= 0 |
| B�������淴Ӧ�ﵽƽ��״̬ʱ��ÿ�ֳɷֵ������������ֲ��� |
| C�������Ѵ�ƽ��Ŀ��淴Ӧ���ӳ���Ӧʱ������߷�Ӧ���ת���� |
| D�������Ѵ�ƽ��Ŀ��淴Ӧ���ı��������ʱ��ƽ��״̬����ı� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com