
| A. | 凡是含碳元素的化合物都属于有机化合物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂的物质一定是有机化合物 | |
| C. | 所有的有机化合物都易燃烧 | |
| D. | 有机化合物的同分异构现象是有机化合物种类繁多的重要原因之一 |
分析 A.含有碳元素的化合物叫有机化合物,简称有机物,但碳的氧化物、碳酸盐、碳酸虽含碳,但其性质与无机物类似,因此把它们看作无机物;
B.用溴单质易溶于苯说明易溶于汽油、酒精、苯等有机溶剂的物质不一定是有机化合物;
C.多数有机物容易燃烧,有的不容易燃烧;
D.分子中碳原子越多,同分异构体越多.
解答 解:A.含有碳元素的化合物不一定是有机物,例如,碳酸钙中含有碳元素,它是无机物,故A错误;
B.易溶于汽油、酒精、苯等有机溶剂的物质不一定是有机化合物,如溴单质易溶于有机溶剂,但溴是无机物,故B错误;
C.多数有机物容易燃烧,有的不容易燃烧,如四氯化碳不容易燃烧,可做灭火剂,故C错误;
D.分子中碳原子越多,同分异构体越多,一种分子可能有多种同分异构体,则同分异构现象是有机化合物种类繁多的重要原因之一,故D正确.
故选D.
点评 本题考查有机物的性质及与无机物的区别,题目难度不大,注意大多数有机物能燃烧,但四氯化碳能作灭火剂.


科目:高中化学 来源: 题型:选择题
| A. | 食醋和料酒的主要成分都是有机酸 | |
| B. | 食盐和味精的成分中都含有钠离子 | |
| C. | 食用油和人造奶油都是油酸甘油酯 | |
| D. | 蔗糖和小苏打都是可溶于水的电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 以石墨作电极电解氯化铝溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑ | |
| C. | 向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| D. | 向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的网状结构中,由共价键形成的硅原子环中,最小的环上有6个硅原子 | |
| B. | 氯化铯晶体中,Cs+的配位数为8 | |
| C. | 氯化钠晶体中,每个Cl-周围距离相等且最近的Cl-有6个 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 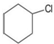 | B. | 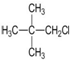 | C. | 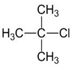 | D. | 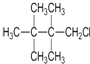 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 赏心悦目的雕花玻璃是用氢氟酸对玻璃刻蚀制成的 | |
| B. | 正常雨水的PH为7 | |
| C. | 生物质能的缺点是严重污染环境 | |
| D. | 煤、石油、沼气是当今世界最重要的三种化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com