
| ��� | 35mL�Լ� | ���� | ���ǰ�¶ȡ� | ��Ϻ��¶ȡ� |
| �� | ˮ | 2.5gNaHCO3 | 20.0 | 18.5 |
| �� | ˮ | 3.2gNa2CO3 | 20.0 | 24.3 |
| �� | ���� | 2.5gNaHCO3 | 20.0 | 16.2 |
| �� | ���� | 3.2gNa2CO3 | 20.0 | 25.1 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
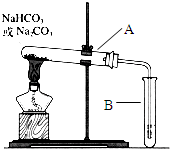
��2010?���Ŷ�ģ��Ϊ̽��NaHCO3��Na2CO3�����ᣨ��������Ũ�Ⱦ�Ϊ1mol?L-1����Ӧ�����е���ЧӦ������ʵ�鲢�����������
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
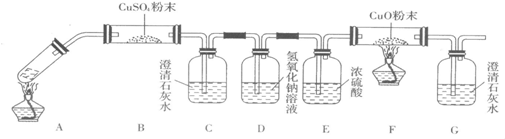
 ijУ��ѧ��ȤС�飬ͨ������װ��̽��Na2CO3��NaHCO3�����ȶ��ԣ�������µ�̽��������������벢��ɸ�̽��������
ijУ��ѧ��ȤС�飬ͨ������װ��̽��Na2CO3��NaHCO3�����ȶ��ԣ�������µ�̽��������������벢��ɸ�̽���������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ���ѡ��
| Ϊ̽��NaHCO3��Na2CO3�����ᣨ��������Ũ�Ⱦ�Ϊ1 mol/L����Ӧ�����е���ЧӦ������ʵ�鲢����� ������ |
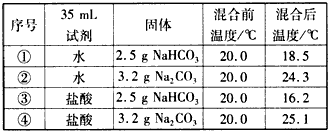 |
| �ɴ˵ó��Ľ�����ȷ���� |
| [ ] |
| A��Na2CO3��Һ������ķ�Ӧ�����ȷ�Ӧ B��NaHCO3��Һ������ķ�Ӧ�Ƿ��ȷ�Ӧ C��20.0��ʱ����3.2 g Na2CO3�ı�����Һ��35 mL�����Ϻ���¶Ƚ�����25.1�� D��20.0��ʱ����2.5 g NaHCO3�ı�����Һ��35 mL�����Ϻ���¶Ƚ�����16.2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com