
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr下列关于此电池说法正确的是( )| A. | 放电过程中钠离子从左到右通过离子交换膜 | |
| B. | 电池充电时,阴极反应为:3NaBr+2e-=NaBr3+2Na+ | |
| C. | 电池中右侧的电解质溶液为Na2S2-Na2S4混合溶液 | |
| D. | 充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.1mol电子 |
分析 根据总反应2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr可知放电过程时,S元素的化合价从-1价上升到-$\frac{1}{2}$价,Br元素的化合价从-$\frac{1}{3}$价降到-1价,则放电时负极反应为2S22--2e-=S42-,正极反应为Br3-+2e-=3Br-;充电时与放电相反,电池充电时外接电源的正极与电池的正极相连,负极与负极相连,则左边为电池的正极,右边为电池的负极,据此解答.
解答 解:A.由图可知给电池充电时外接电源的正极与电池的正极相连,负极与负极相连,则左边为电池的正极,右边为电池的负极,放电过程为原电池,阳离子向正极移动,则钠离子从右到左通过离子交换膜,故A错误;
B.电池充电时,阴极发生还原反应,与放电过程负极电极反应相反,电极反应式为S42-+2e-=2S22-,故B错误;
C.左边电极为正极,正极反应为Br3-+2e-=3Br-,则电池左侧接触的电解质溶液应为NaBr3和NaBr的混合溶液,右边电极为负极,负极反应为2S22--2e-=S42-,则电池右侧接触的电解质溶液应为Na2S2-Na2S4的混合溶液,故C正确;
D.有0.1molNa+通过离子交换膜,说明有0.1mol电子转移,导线通过0.1mol电子,故D正确;
故选CD.
点评 本题考查了原电池和电解池工作原理的应用,注意从元素化合价的升降来把握电极的判断方法和电极反应的书写是解题的关键,题目难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | X | T | Y | Z | W | M | N |
| 主要化合价 | +1 | -2 | -1 | +1 | +2 | +2、-2 | +7、-1 |
| 结构或用途 | 原子半径最小 | 地壳中含量最高的元素 | 非金属性最强 | 一种含氧化物可用作供氧剂 | 次外层电子数是最外层电子数的4倍 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 用热的浓盐酸除去试管内壁的MnO2:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .A中反应的氧化剂和还原剂的物质的量之比为1:2.
.A中反应的氧化剂和还原剂的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
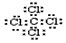 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | NH3、CO、CS2都是极性分子 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:N>F>O | |
| D. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com