
| 实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源:不详 题型:填空题
 H++A2-。回答以下问题:
H++A2-。回答以下问题:| A.c(H+)·c(OH-)=1×10-14 mol·L-1 |
| B.c(Na+)+c(K+)=c(HA-)+2c(A2-) |
| C.c(Na+)>c(K+) |
| D.c(Na+)+c(K+)=0.05 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HCN+NaNO2,NaCN+HF
HCN+NaNO2,NaCN+HF HCN+NaF,NaNO2+HF
HCN+NaF,NaNO2+HF HNO2+NaF
HNO2+NaF| A.K(HF)=7.2×10-4 |
| B.K(HNO2)=4.9×10-10 |
| C.根据其中两个反应即可得出结论 |
| D.K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 增大
增大| A.①②③ | B.①③⑤ | C.①③⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.0×10-8 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.都能使溶液的pH增加 |
| B.都能使溶液中c(H+)·c(CH3COO-)增大 |
C.都能使溶液中 比值增大 比值增大 |
| D.溶液中c(H+)·c(OH-)不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++H2PO3—。
H++H2PO3—。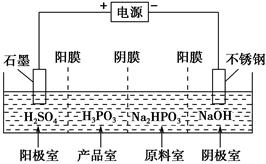
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应过程中,两个烧杯中产生氢气的速率一直相等 |
| B.反应结束后,两个烧杯中产生氢气的物质的量相等 |
| C.反应结束后,乙烧杯中有镁粉剩余 |
| D.反应结束后,甲烧杯中溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com