
| A. | ① | B. | ②⑤ | C. | ④ | D. | ③④ |
分析 必须加入氧化剂且一步反应能完成,说明选项中给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:①NO2→NO中N元素化合价由+4价变为+2价,得电子作氧化剂,需要还原剂才能实现,故错误;
②NO2→HNO3中N元素化合价由+4价变为+5价,但NO2与水反应生成HNO3,NO2既作氧化剂又作还原剂,不一定必须加入氧化剂,故错误;
③N2→NO2 中N元素化合价由0价变为+4价,失电子作还原剂,需要氧化剂才能实现,但氮气和氧气反应生成NO而不是二氧化氮,所以一步不能完成,故错误;
④N2→NO 中N元素化合价由0价变为+2价,氮气失电子作还原剂,需要加入氧化剂才能实现,即氮气和氧气反应生成NO,故正确;
⑤N2→NH3中N元素化合价由0价变为-3价,得电子作氧化剂,需要还原剂才能实现,故错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,明确元素化合价与性质关系是解本题关键,易错选项是②.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | A、C、D三种元素形成的化合物一定是共价化合物 | |
| B. | 工业上常用电解E与F形成的化合物的方法制取单质E | |
| C. | 原子半径由大到小的顺序:D>C>B>A | |
| D. | B、C、F元素最高价氧化物水化物酸性最强的是F |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
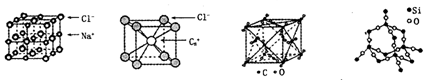
| A. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同 的晶体结构 | |
| B. | 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似物理 性质 | |
| C. | 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| D. | 二氧化硅晶体不是密堆积结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4个共价键 | |
| B. | 碳原子性质活泼,可以与多数非金属元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成双键和三键 | |
| D. | 多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①④⑤ | C. | ②③⑥ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com