
| A、黄钾铁矾中铁元素显+3价 |
| B、黄钾铁矾属于碱 |
| C、黄钾铁矾溶于硫酸后,滴加KSCN溶液,溶液变红 |
| D、黄钾铁矾晶体在酒精灯火焰上灼烧,透过蓝色的钴玻璃可观察到紫色火焰 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、相同条件下A占的体积比B大 |
| B、A的摩尔质量比B大 |
| C、A的分子数比B少 |
| D、A的物质的量比B小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH
U、V、W、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知U的一种核素的质量数为14,中子数为7;V的离子与NH+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
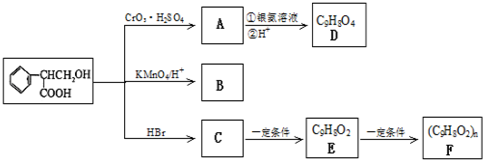
| CO2?H2SO4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com