
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
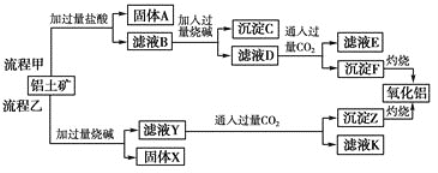
请回答下列问题:
(1) 流程乙加入烧碱后生成SiO32-的离子方程式为________________________________。
(2) 写出由滤液D生成Al(OH)3的离子方程式: ________________________________。
(3)向滤液Y中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。
(4) 滤液E、K中溶质的主要成分是________(填化学式)。
(5) 已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=________。
【答案】SiO2+2OH-=SiO32-+H2O AlO2-+CO2+2H2O = Al(OH)3↓+HCO3- 减小 NaHCO3 5.6×10-10mol·L-1
【解析】
流程甲:加入过量的盐酸,二氧化硅不溶解,则固体A为二氧化硅;溶液B为氯化铝、氯化铁、氯化镁和剩余的盐酸;加入过量的烧碱,沉淀C为氢氧化铁、氢氧化镁;滤液D为偏铝酸钠、氯化钠和剩余的NaOH溶液;通入过量的二氧化碳,沉淀F为氢氧化铝;滤液E为氯化钠、碳酸氢钠;
流程乙:加入过量的烧碱,氧化铁、氧化镁不溶,固体X为氧化镁、氧化铁;滤液Y为偏铝酸钠、硅酸钠和剩余的NaOH溶液;通入过量的二氧化碳,沉淀Z为氢氧化铝,滤液K为碳酸氢钠;
(1)流程乙加入烧碱后,二氧化硅与氢氧化钠反应生成硅酸钠和水,离子方程式为SiO2+2OH-=SiO32-+H2O;
(2)写出由滤液D主要为偏铝酸钠,与二氧化和水反应,生成Al(OH)3、碳酸氢根离子,离子方程式为AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;
(3)滤液Y为偏铝酸钠、硅酸钠和剩余的NaOH溶液,加入NaHCO3溶液,消耗剩余的NaOH,则pH减小;
(4)分析可知,滤液E、K中溶质的主要成分是碳酸氢钠;
(5)液B为氯化铝、氯化铁、氯化镁和剩余的盐酸,加入烧碱达到沉淀溶解平衡,测得pH=13.00,则c(OH-)=0.1mol/L,根据Ksp=5.6×10-12,c(Mg2+)=Ksp/c2(OH-)=5.6×10-10。


科目:高中化学 来源: 题型:
【题目】下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项的编号和曲线的编号一一对应,其中描述错误的是

A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入CO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关《化学反应原理》的内容说法不正确的是
A. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
B. 向FeCl3与CuCl2溶液中加入碱式碳酸铜调节pH可以除去溶液中的FeCl3
C. 使用催化剂,可以增大活化分子百分数,加快反应速率
D. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中正确的是
A. 提取溶解在水中的少量碘:加入酒精振荡、静置分层后,取出有机层再分离
B. 下图所示装置都适宜于HCl气体尾气吸收
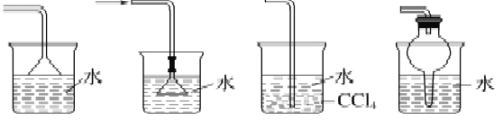
C. 酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差;在用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体。
D. 除去酸性MgCl2溶液中少量的FeCl3:加入足量的Mg(OH)2 并过滤;除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是_______________________ 。
(2)A的化学式为_____________________,D的化学式为_____________________,D溶液显碱性的原因是(用离子方程式表示):__________________________。
(3)E和氨水反应的离子方程式是________________________________。E与D反应的离子方程式是__________。
(4)设计实验检验B中所含的阳离子:_____________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷与NaOH水溶液共热的反应方程式:_______________,某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:____________________。
(2)写出溴乙烷与NaOH乙醇溶液共热的反应方程式:________,反应中生成的气体可以用如图所示装置检验,现象是______,水的作用是 ______。

(3)乙烯使溴水褪色的化学方程式: __________________________,X是比乙烯相对分子质量大14的乙烯的同系物,工业上用X生产塑料的化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,
试回答下列问题:
(1)写出滴定实验中所发生反应的离子方程式:_________________________________________________________
(2)实验中KMnO4溶液应装在___________式滴定管中,滴定终点的判断依据是_______________________________
(3)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1
(4)若滴定终点读数时目光俯视,则计算出的x值可能_______________(填“偏大”、“偏小”、“无影响”)
(5)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加。
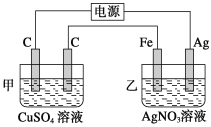
(1)写出甲中发生反应的化学方程式:____________________________。
(2)写出乙中两极发生的电极反应式。
阳极:_______________;阴极:_____________________。
Ⅱ.在一定温度下,将2mol A和2mol B两种气体相混合于容积为2 L的某密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),2min末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.3mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.3mol/L,请填写下列空白:
(1)x值等于__________。
(2)A的转化率为__________。
(3)生成D的反应速率为________________。
(4)达平衡后保持容器内气体压强不变,向其中加入He(He不参加反应),则平衡______移动(填“正向”“逆向 “或”“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4均为温室气体,若得以综合利用,对温室气体整治具有重大意义。
(1)已知:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) △H=+247.3kJ·mol-1
2CO(g)+2H2(g) △H=+247.3kJ·mol-1
CH4(g)![]() C(s)+2H2(g) △H=+75.0kJ·mol-1
C(s)+2H2(g) △H=+75.0kJ·mol-1
反应2CO(g)![]() C(s)+CO2(g)在_______能自发进行。
C(s)+CO2(g)在_______能自发进行。
A、高温 B、低温 C、任意温度 D、任意温度都不能
(2)合成甲醇的主要反应是CO(g)+2H2(g)![]() CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
CH3OH(g)。初始压强P1下,向体积为2L的恒容密闭容器中充入b mol CO和2b mol H2,平衡时CO的转化率与温度、压强的关系如图所示。请回答:
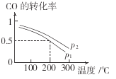
①下列判断正确的是______
A、放热反应 P1>P2 B、放热反应 P1<P2
C、吸热反应 P1>P2 D、吸热反应 P1<P2
②200℃时,该反应的平衡常数K=_______(用含b的代数式表示)。若上述反应经过tmin达到平衡,则该时间段内氢气的平均反应速率为_______。
(3)实验室可用Na2CO3 与盐酸混合制备少量CO2。在25℃时,取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示。则:
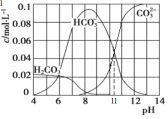
①根据图中数据,计算CO32-的水解常数K=____________________。
②pH = 6的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)_____(填>、<或=)0.1 mol·L-1
(4)以甲烷为燃料的酸性燃料电池负极反应式:___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com