
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
科目:高中化学 来源: 题型:
【题目】(1)海水淡化的方法主要有:__________、______________、_____________。
(2)金属冶炼的实质是金属化合物中的金属离子得电子被________(填“氧化”或“还原”)为金属单质的过程,写出冶炼金属钠的化学方程式:_________________________。
(3)实验室里,常用加热铵盐和碱的混合物的方法制氨,写出实验室制氨的化学方程式:________;氨溶于水得氨水,氨水呈___________性(填“酸”或“碱”); 密度比水_______;(填“大”或“小”)写出向AlCl3溶液中滴加过量氨水的离子方程式:_________________________。
(4)溴主要以Br-形式存在于海水中,工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物。
Br2可用热空气吹出,其原因是:_________;步骤③所发生的化学反应方程式为:_______________。
【答案】蒸馏法电渗析法离子交换法还原 2NaCl(熔融)![]() 2Na+Cl2↑2NH4Cl+Ca(OH)2
2Na+Cl2↑2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O碱小Al3++3NH3·H2O = Al(OH)3↓+3NH4+溴的沸点较低,易挥发5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
CaCl2+2NH3↑+2H2O碱小Al3++3NH3·H2O = Al(OH)3↓+3NH4+溴的沸点较低,易挥发5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
【解析】
海水淡化的常用方法有海水冻结法、电渗析法、蒸馏法、离子交换法;金属冶炼的实质其实就是把金属从化合态变为游离态,用还原的方法使金属化合物中的金属阳离子得电子变成金属原子,原理就是利用氧化还原反应原理在一定条件下用还原剂把金属矿石中的金属离子还原成金属单质;实验室用消石灰与氯化铵共热的方法制备氨气,氨气溶于水溶液呈碱性,密度比水小;溴易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质。
(1)淡化海水,应将水与海水中的盐进行分离,常用方法有蒸馏、电渗析以及离子交换法等。(2)金属冶炼的实质其实就是把金属从化合态变为游离态,用还原的方法使金属化合物中的金属阳离子得电子变成金属原子,工业上用电解熔融的氯化钠冶炼金属钠,反应的化学方程式为:2NaCl(熔融)![]() 2Na+Cl2↑。(3)实验室用消石灰与氯化铵共热的方法制备氨气,消石灰与氯化铵共热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2
2Na+Cl2↑。(3)实验室用消石灰与氯化铵共热的方法制备氨气,消石灰与氯化铵共热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气溶于水溶液呈碱性,氨水密度比水小;氨水与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵溶液,反应的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+。(4)海水提溴时,溴的沸点较低,易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质,反应的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4
CaCl2+2NH3↑+2H2O;氨气溶于水溶液呈碱性,氨水密度比水小;氨水与氯化铝溶液反应生成氢氧化铝沉淀和氯化铵溶液,反应的离子方程式为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+。(4)海水提溴时,溴的沸点较低,易挥发,可用热空气吹出;NaBr、NaBrO3在酸性条件下可发生氧化还原反应生成溴单质,反应的化学方程式为5NaBr+NaBrO3+3H2SO4=3Na2SO4
+3Br2+3H2O。
【题型】填空题
【结束】
27
【题目】一瓶未知溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42-、CO32-、Cl-和I-。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入NaOH 溶液使其变为碱性,无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
根据上述实验事实,可知原溶液中肯定含有的离子是_________;肯定没有的离子是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内不同化学元素所组成的化合物,以下说法不正确的是( )

A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若③为多聚体,且能贮存生物的遗传信息,则③一定是RNA
C. 若②存在于皮下和内脏器官周围等部位,则②是脂肪
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是

A. t2时加入了催化剂 B. t3时降低了温度
C. t5时增大了压强 D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次递增的短周期主族元素,X和Y组成的某二元化合物是生产普通玻璃所需主要原料之一,Z的K层电子数与最外层电子数之和等于次外层电子数,WX2和W2X4中的化合价相同,且二者可以互相转换。下列有关说法中正确的是
A. 原子半径大小:Z>X>W
B. WX2和W2X4均能与水发生化合反应
C. 最高价氧化物对应水化物的酸性:Y>Z
D. 常压下,常见单质的熔点:Z>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)可作为半导体村料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________性,区分这两种形态的SiO2最可靠的方法足对固体进行___________实验。
(2)基态砷原子的价层电子排布图为_____________,最高能层符号为_____________,Ge、As、Se第一电离能从大到小的顺序为_____________________。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________。
化学键 | C-C | C-H | Ge-Ge | Ge-H |
键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为_____________,GeH4分子中Ge的_____________轨道和H的_________轨道重叠形成σ键。
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________pm(只列出算式即可),Ga-As键中共用电子对偏向____________(填“Ga”或“As”)。
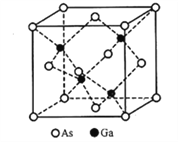
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下图是元素周期表中的一格,从中获取的信息不正确的是( )

A. 该元素的元素符号为Ar
B. 该元素属于金属元素
C. 该元素的原子核外有18个电子
D. 该元素的相对原子质量为39.95
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com