
【题目】阿司匹林(乙酰水杨酸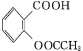 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备的主要反应为
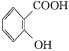 +(CH3CO)2O
+(CH3CO)2O![]()
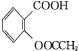 +CH3COOH
+CH3COOH
制备基本操作流程如下:
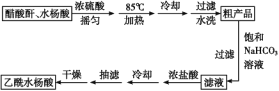
主要试剂和产品的物理常数:
名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
水杨酸 | 138 | 158(熔点) | 微溶 |
醋酸酐 | 102 | 139.4(沸点) | 反应 |
乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)合成过程中最合适的加热方法是__________。
(2)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再过滤,则加饱和NaHCO3溶液的目的是______
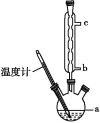
(3)另一种改进的提纯方法,称为重结晶提纯法。改进的提纯方法中加热回流的装置如图所示,仪器a的名称是____,冷凝管中冷凝水的进入口是____(填“b”或“c”),使用温度计的目的是_________
(4)检验产品中是否含有水杨酸的化学方法是_________
(5)该学习小组在实验中原料用量:2.76 g水杨酸、7.5 mL醋酸酐(ρ=1.08 g/cm3),最终称量产品m=2.92 g,则所得乙酰水杨酸的产率为____。
【答案】水浴加热 使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离 三颈烧瓶 b 控制反应温度,防止乙酰水杨酸受热分解 取少量结晶产品于试管中,加蒸馏水溶解,滴加FeCl3溶液,若溶液呈紫色则含水杨酸 81.1%
【解析】
(1)合成的温度为85℃,所以可以采取水浴加热;
(2)加入饱和NaHCO3溶液使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离,故答案为:使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离;
(3)冷凝管中水的流向是下口进水,上口出水。由于乙酰水杨酸受热易分解,所以使用温度计控制反应温度,防止乙酰水杨酸受热分解。故答案为:三颈烧瓶,b,控制反应温度,防止乙酰水杨酸受热分解;
(4)乙酰水杨酸和水杨酸中都有羧基,但水杨酸中有酚羟基,可以用FeCl3溶液检验酚羟基,进而检验产品中是否含有水杨酸,故答案为:取少量结晶产品于试管中,加蒸馏水溶解,滴加FeCl3溶液,若溶液呈紫色则含水杨酸;
(5)2.76g水杨酸为0.02mol,乙酸酐为7.5 mL×1.08 g/cm3÷102g/mol=0.08mol,所以乙酸酐是过量的,生成的乙酰水杨酸的物质的量和水杨酸的物质的量相等,所以乙酰水杨酸的质量为0.02mol×180g/mol=3.6g。则所得乙酰水杨酸的产率为![]() ×100%≈81.1%。
×100%≈81.1%。


科目:高中化学 来源: 题型:
【题目】用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:

下列说法错误的是
A. 设计步骤①、②、③的主要目的是富集MgCl2
B. 脱水时在HCl气氛中进行可防止MgCl2发生水解
C. 电解得到的炽热镁粉不可在二氧化碳、氮气气氛中冷却
D. 上述工艺流程中涉及到的反应有置换反应、化合反应、复分解反应、分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则下列说法正确的是
2SO3(g)为放热反应,则下列说法正确的是
A.单位时间内生成2molSO2,同时生成1molO2,说明反应达到平衡状态
B.上述热化学反应方程式说明反应物的总键能小于生成物的总键能
C.升高温度,正反应速率增大,逆反应速率减小
D.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后生成2molSO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体吸入CO后在肺中发生反应CO+HbO2![]() O2+HbCO导致人体缺氧。向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L],氧合血红蛋白 HbO2浓度随时间变化曲线如图所示。下列说法正确的是( )
O2+HbCO导致人体缺氧。向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L],氧合血红蛋白 HbO2浓度随时间变化曲线如图所示。下列说法正确的是( )

A.反应开始至4s内用HbO2表示的平均反应速率为2×l0-4mol/(L·s)
B.反应达平衡之前,O2与HbCO的反应速率逐渐减小
C.将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理
D.该温度下反应CO+HbO2 ![]() O2+HbCO的平衡常数为107
O2+HbCO的平衡常数为107
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法正确的是

A.用澄清的石灰水可鉴别NaHCO3和Na2CO3
B.溴元素在第③、⑤中被氧化,在第④中被还原
C.工业上一般用金属钠与无水MgCl2反应制取Mg单质
D.海水中还含有碘元素,只需将海水中的碘升华就可以得到碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金X由常见的两种元素组成。为探究该合金X的元素组成和性质,设计并进行如下实验:
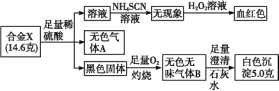
根据上述信息,回答下列问题:
(1)合金X的化学式为________。
(2)用离子方程式解释溶液中滴加H2O2后呈红色的原因:_______
(3)写出336 mL(标准状况)气体B通入100 mL 0.2 mol/L 的NaOH溶液中的化学反应方程式:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦NO2 ⑧SO2,下列操作正确的是( )

A.在烧瓶中充满水,由A进气收集①③⑤⑦
B.在烧瓶中充满水,由B进气收集⑥
C.烧瓶是干燥的,由A进气收集①③⑤
D.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、金属铋生产中,副产品 NaBiO3可作测定锰的氧化剂。工业上常用辉铋矿(主要成分是Bi2S3,还含有少量SiO2等杂质),制备BiOCl和NaBiO3(二者都难溶于水),其流程如下:
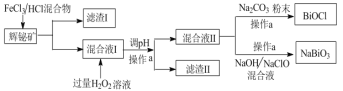
(1)操作a使用的玻璃仪器是_____________,工业上制备HCl的反应原理是:_____。
(2)滤渣I中的成分为________,分离滤渣I中的成分的物理方法是:__________。
(3)请从平衡角度解释调pH产生滤渣Ⅱ的原因:__。
(4)混合液 II 中加入 Na2CO3粉末,当混合液Ⅱ中____________(填实验现象)时,说明BiOCl的生成已完成。混合液II中加入NaOH和NaClO发生的离子方程式________。
(5)加入 H2O2发生反应的离子方程式_______,过滤后,如何洗涤BiOCl固体_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种有机物,它们的分子分别由—CH3、—OH、—COOH、—CHO、—C6H5( 代表苯基)中的两种组成,这些化合物的性质如下所述:
①A能够发生银镜反应,且相对分子质量为44;
②B溶液加入氯化铁溶液中,溶液显紫色;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应。
请回答下列问题:
(1)B、D的结构简式是:B_____D______
(2)写出A发生银镜反应的化学方程式:________
(3)C和E发生酯化反应的化学方程式:_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com