
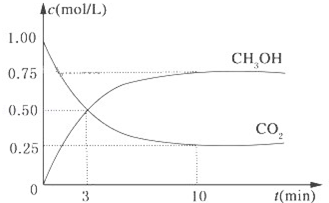
 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.分析 (1)根据v=$\frac{△c}{△t}$计算;
(2)根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
(3)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
(4)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(5)恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变.
解答 解:(1)利用三段式解题法计算
CO2(g)+3H2(g)  CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol•L-1•min-1,
故答案为:0.225;
(2)氢气的转化率=$\frac{2.25}{3}$=75%,
故答案为:75%;
(3)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案为:5.33;
(4)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol H2,增大反应物浓度,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD;
(5)若是恒容密闭容器、反应后整个体系的压强比之前来说减小了,加入氢气虽然正向移动,平衡移动的结果是减弱这种改变,而不能消除这种改变,即虽然平衡正向移动,氢气的物质的量在增加后的基础上减小,但是CO2(g)浓度较小、CH3OH(g) 浓度增大、H2O(g)浓度增大,且平衡常数不变达到平衡时H2的物质的量浓度与加氢气之前相比一定增大,故c1<c2,
故答案为:<.
点评 本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,为高考常见题型,侧重于学生的分析、计算能力的考查,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:填空题
按要求填写除杂试剂及分离提纯的方法(括号中为杂质)
(1)CH4(C2H4):通过盛有 的洗气瓶
(2)乙醇(水):先加 后通过 来加以分离
(3)乙酸乙酯(乙酸):先加 后通过 法加以分离
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
在通风厨中进行下列实验,下列说法不正确的是( )
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
A.I中气体由无色变为红棕色的化学方程式:2NO+O2===2NO2
B.II中的现象说明Fe表面形成致密的氧化膜,阻止Fe进一步反应
C.对比I、II中的现象,说明稀HNO3的氧化性强于浓HNO3
D.针对III中的现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
在一定条件下,RO3n-和氟气可发生如下反应:RO3n- + F2 + 2OH- == RO4- + 2F- + H2O,从而可知在RO3n-中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
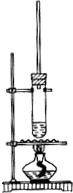 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图.下列对该实验的描述错误的是( )| A. | 为了控制温度可以用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 加入过量乙酸可以提高1-丁醇的转化率 | |
| D. | 提纯乙酸丁酯可用饱和碳酸钠溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
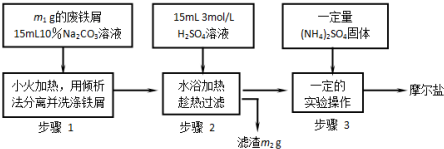
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com