
| A. | H2RO3 | B. | H2RO4 | C. | HRO3 | D. | HRO4 |
科目:高中化学 来源: 题型:实验题
 在试管a中先加入2mL 95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
在试管a中先加入2mL 95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验现象 | |
| A | 滴入淀粉溶液 | 溶液变蓝色 |
| B | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| C | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| D | 滴入KSCN溶液 | 溶液变红色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 | |
| B. | 香兰素、阿魏酸均可与Na2CO3、NaOH、NaHCO3溶液反应 | |
| C. | 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 | |
| D. | 与香兰素互为同分异构体分子中有4种不同化学环境的氢,能消2molNaOH溶液且能发生银镜反应的酚类化合物共有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是一种酸性氧化物,能够与水反应生成相应的酸 | |
| B. | 光导纤维的主要成分是硅 | |
| C. | 实验室保存氢氧化钠溶液不能用玻璃塞 | |
| D. | 晶体硅具有金属光泽,可以导电,因此晶体硅属于金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下不能用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都增加 | |
| C. | 露置在空气中,容器内酸液的浓度都减小 | |
| D. | 常温下都能与铜剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C.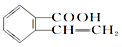 D.
D.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com