
 PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、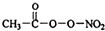 (PAN)等二次污染物.
(PAN)等二次污染物.分析 ①单键为σ键,双键中含有1个σ键,1个π键;一般非金属性越强第一电离能越弱,同周期随原子序数增大第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
②中心原子或离子含有空轨道,配体含有孤对电子,中心离子为Fe2+,Fe原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子形成Fe2+;
③HCOOH分子间能形成氢键,CH30CH3不能形成分子间氢键.
解答 解:①单键为σ键,双键中含有1个σ键,1个π键,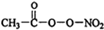 中共有10个σ键,所以1mol PAN中含有的σ键数目为10mol;一般非金属性越强第一电离能越弱,同周期随原子序数增大第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:,
中共有10个σ键,所以1mol PAN中含有的σ键数目为10mol;一般非金属性越强第一电离能越弱,同周期随原子序数增大第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:,
故答案为:10mol;N>O>C>H;
②Fe2+含有空轨道,为中心离子,NO、H2O含有孤对电子,为配体,该配合物中中心离子的配位数为6,Fe原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子形成Fe2+,Fe2+的核外电子排布式为:1s22s22p63s23p63d6,
故答案为:6;1s22s22p63s23p63d6;
③HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以相同压强下,HCOOH的沸点比CH3OCH3高,
故答案为:高;HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键.
点评 本题是对物质结构与性质的考查,涉及化学键、电离能、核外电子排布、配合物、氢键等,注意理解同周期第一电离能异常情况,注意氢键对物质性质的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:3 | C. | 1:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 一溴代二甲苯 | 234℃ | 20℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
| 对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
| A. | 邻二甲苯 | B. | 间二甲苯 | C. | 对二甲苯 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
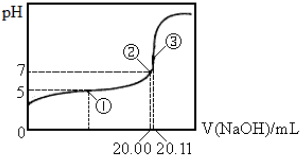
| A. | 该温度下CH3COOH的电离平衡常数Ka=2.0×10-5 | |
| B. | ③点所示溶液中:c(CH3C00-)+c(CH3C00H)=(Na+)+c(0H-) | |
| C. | 该醋酸的浓度为0.1006mol•L-1 | |
| D. | 由图示可以计算醋酸钠的水解平衡常数为5.0×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10gH2和10gCO | B. | 11.2LCO(标准状况)和22gCO2 | ||
| C. | 18gH2O和44gCO2 | D. | 22.4LH2和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
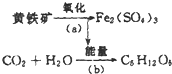 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com