
【题目】肉桂酸甲酯(H)常用作食用香精。用芳香烃A为原料先合成肉桂酸G(![]() ),继而合成H的路线如下:
),继而合成H的路线如下:

请回答下列问题:
(1)化合物A的结构简式为___________。
(2)B→C所加试剂的名称是______________,F→G的反应类型为__________。
(3)G→H的化学方程式为__________________。
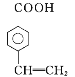
(4)写出与肉桂酸互为同分异构体,且能使溴的四氯化碳溶液褪色,还能与碳酸氢钠溶液反应的所有同分异构体的结构简式_________。
【答案】![]() NaOH水溶液 消去反应
NaOH水溶液 消去反应 ![]() +CH3OH
+CH3OH ![]()
![]() +H2O
+H2O ![]() 、
、 、
、 、
、
【解析】
C的不饱和度=(9×2+2-12)/2=4,C的不饱和度为4,结合D结构简式知,C中含有一个苯环,C结构简式为![]() ,B发生取代反应或水解反应生成C,B结构简式为
,B发生取代反应或水解反应生成C,B结构简式为![]() ,A发生加成反应生成B,A结构简式为
,A发生加成反应生成B,A结构简式为![]() ;结合E分子式知,D发生氧化反应生成E,E结构简式为
;结合E分子式知,D发生氧化反应生成E,E结构简式为 ,E发生加成反应结合F分子式知,F结构简式为
,E发生加成反应结合F分子式知,F结构简式为![]() ,F发生消去反应生成G:
,F发生消去反应生成G:![]() ,G与甲醇CH3OH发生酯化反应生成H,H结构简式为
,G与甲醇CH3OH发生酯化反应生成H,H结构简式为![]() ,据此分析解答。
,据此分析解答。
(1)通过以上分析知,A的结构简式为![]() ;
;
(2)B是![]() ,B是卤代烃,在NaOH水溶液中发生取代反应生成C
,B是卤代烃,在NaOH水溶液中发生取代反应生成C![]() ,因此B→C所加试剂的名称是NaOH水溶液;F是
,因此B→C所加试剂的名称是NaOH水溶液;F是![]() ,与浓硫酸在加热条件下发生消去反应生成G:
,与浓硫酸在加热条件下发生消去反应生成G:![]() ,所以F→G的反应类型是消去反应;
,所以F→G的反应类型是消去反应;
(3)G是![]() ,与甲醇CH3OH在浓硫酸存在时,在加热条件下发生酯化反应生成H:
,与甲醇CH3OH在浓硫酸存在时,在加热条件下发生酯化反应生成H:![]() +CH3OH
+CH3OH ![]()
![]() +H2O;
+H2O;
(4)与肉桂酸互为同分异构体,且能使溴的四氯化碳溶液褪色,说明该物质内含有不饱和碳碳键,还能与碳酸氢钠溶液反应,说明含有羧基,符合条件的同分异构体结构简式为![]() 、
、 、
、 、
、 。
。


科目:高中化学 来源: 题型:
【题目】向含有1 mol KI的溶液中加入含0.1 mol X2O72的酸性溶液,使溶液中I-恰好全部被氧化生成I2,并使X2O72 被还原为Xn+,则n值为
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家很早就提出锂-空气电池的概念,它直接使用金属锂作电极,从空气中获得O2,和以LiFePO4作电极的锂离子电池相比,增大了电池的能量密度(指标之一是单位质量电池所储存的能量)。右图是某种锂-空气电池的装置示意图,放电时,下列说法不正确的是

A. 金属锂为负极
B. 若隔膜被腐蚀,不会影响该电池正常使用
C. 多孔碳电极上发生的电极反应为:O2 + 2H2O + 4e- === 4OH-
D. 锂-空气电池能量密度大的原因之一是转移等量电子时,金属锂比LiFePO4质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种气体的原子数一定相等的是
A. 质量相等、密度不等的N2和C2H4
B. 等体积、等密度的CO和N2
C. 等温、等体积的O2和Cl2
D. 等压、等体积的NH3和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
质量分数/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:

(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H22NH3 ,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
(1)处于平衡状态的时间段是________(填选项).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氮气
t1时刻________;t3时刻________;t4时刻________.
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是________(填选项).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,此时正向速率________逆向速率(填大于、小于、等于),平衡________移动(填正向、逆向、不移动)。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向H2C2O4溶液中滴加NaOH溶液,若pc=-lg c,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是

A. M点时, 2c(HC2O4-)+c(C2O42-) >c(Na+)
B. pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. 常温下,Ka2(H2C2O4)=10-1.3
D. ![]() 随pH的升高而减小
随pH的升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1mol/L的氢氧化钠溶液与0.06mol/L硫酸溶液等体积混合,溶液的pH等于
A. 1.7 B. 2.0 C. 10 D. 12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com