
【题目】往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。Mg(OH)2是一种常用的阻燃剂,生产工艺如下:
![]()
完成下列填空:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClxmH2O],反应的化学方程式为___。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:Mg(OH)2-xClxmH2O→(1-![]() )Mg(OH)2+
)Mg(OH)2+![]() MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是___。
(4)已知热化学方程式:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJmol-1
Al(OH)3(s)→![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g)-87.7kJmol-1
H2O(g)-87.7kJmol-1
Mg(OH)2和Al(OH)3起阻燃作用的主要原因是___。等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是___,原因是___。
(5)该工业生产的原料还可以用来提取金属镁。请设计提取金属镁的工艺流程(框内写产物名称,箭头上标明转化条件):___
![]()
【答案】2MgCl2+(2-x)Ca(OH)2+2mH2O=2[Mg(OH)2-xClxmH2O]+(2-x)CaCl2 除去附着在Mg(OH)2表面的可溶性物质MgCl2、CaCl2、Ca(OH)2等 水热处理、表面处理 Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳 Mg(OH)2 Mg(OH)2;Mg(OH)2的吸热效率为:![]() =1.41 kJg﹣1,Al(OH)3的吸热效率为:
=1.41 kJg﹣1,Al(OH)3的吸热效率为:![]() =1.12 kJg﹣1,等质量的Mg(OH)2比Al(OH)3吸热多
=1.12 kJg﹣1,等质量的Mg(OH)2比Al(OH)3吸热多 
【解析】
石灰乳是氢氧化钙,与新制卤水反应,生成碱式氯化镁[Mg(OH)2-xClxmH2O]和CaCl2;水热处理,可发生如下反应:2Mg(OH)2-xClxmH2O→(1-x)Mg(OH)2+MgCl2+mH2O,过滤得Mg(OH)2,水洗、表面处理、过滤水洗、干燥,即可获得成品Mg(OH)2。
(1)石灰乳的主要成分是氢氧化钙,MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClxmH2O],依据元素守恒,化学反应方程式为:2MgCl2+(2-x)Ca(OH)2+2mH2O=2[Mg(OH)2-xClxmH2O]+(2-x)CaCl2。答案为:2MgCl2+(2-x)Ca(OH)2+2mH2O=2[Mg(OH)2-xClxmH2O]+(2-x)CaCl2;
(2)反应发生后,除生成氢氧化镁外,还生成MgCl2、CaCl2,另外还可能剩余氢氧化钙,故水洗的目的是:除去附着在Mg(OH)2表面的可溶性物质MgCl2、CaCl2、Ca(OH)2等。答案为:除去附着在Mg(OH)2表面的可溶性物质MgCl2、CaCl2、Ca(OH)2等;
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点,上述工艺流程中通过水热处理和表面处理可以使氢氧化镁晶体具有此特点。答案为:水热处理、表面处理;
(4)从两个分解反应的方程式可能看出,Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降,从而使环境温度达到着火点以下,阻止了燃料的燃烧;且同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,使阻燃效果更佳,Mg(OH)2的吸热效率为:![]() =1.41 kJg﹣1,Al(OH)3的吸热效率为:
=1.41 kJg﹣1,Al(OH)3的吸热效率为:![]() =1.12 kJg﹣1,等质量的Mg(OH)2比Al(OH)3吸热多,所以阻燃效果较好的是Mg(OH)2。答案为:Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳;Mg(OH)2;Mg(OH)2的吸热效率为:
=1.12 kJg﹣1,等质量的Mg(OH)2比Al(OH)3吸热多,所以阻燃效果较好的是Mg(OH)2。答案为:Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳;Mg(OH)2;Mg(OH)2的吸热效率为:![]() =1.41 kJg﹣1,Al(OH)3的吸热效率为:
=1.41 kJg﹣1,Al(OH)3的吸热效率为:![]() =1.12 kJg﹣1,等质量的Mg(OH)2比Al(OH)3吸热多;
=1.12 kJg﹣1,等质量的Mg(OH)2比Al(OH)3吸热多;
(5)提取镁的流程中,先加入熟石灰,熟石灰与精制卤水中的氯化镁反应,生成氢氧化镁白色沉淀,过滤后再加入盐酸,氢氧化镁与盐酸反应生成氯化镁和水,蒸发浓缩干燥得到氯化镁(在HCl气流中),熔融氯化镁在通电的条件下生成镁和氯气,故此流程如下: 。答案为:
。答案为: 。
。


科目:高中化学 来源: 题型:
【题目】已知:在300K时,A(g)+B(g)![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时消耗2a mol C
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的密度不再变化
A.②⑤B.②④C.②③D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)===2CO(g)+4H2(g) ΔH=-71 kJ/mol
②CO(g)+2H2(g)===CH3OH(l) ΔH=-90.5 kJ/mol
③CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ/mol
下列不能得出的结论是( )
A.反应②不需要加热就能进行
B.CO(g)+2H2(g)===CH3OH(g) ΔH>-90.5 kJ/mol
C.甲醇的燃烧热ΔH=-764 kJ/mol
D.若CO的燃烧热ΔH=-283.0 kJ/mol,则H2的燃烧热ΔH=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是
A.稀释后溶液的pH=7B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大D.pH = 11氨水的浓度为0.001mol/L
增大D.pH = 11氨水的浓度为0.001mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时将100mLH2S和O2的混合气体,点燃完全反应后恢复到原来状况,体积变为40mL。下列叙述中正确的是( )
A.剩余40mL气体一定是O2
B.剩余40mL气体是H2S或SO2
C.混合气体中含H2S40mL或80mL
D.剩余40mL气体是SO2和O2混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萘普生是重要的消炎镇痛药。以下是它的一种合成路线:

已知:萘(![]() )的化学性质与苯相似。
)的化学性质与苯相似。
完成下列填空:
(1)反应(1)的反应类型是___;A的分子式是___。
(2)反应(2)的试剂和条件是___;反应(3)的产物是D和___(填化学式)。
(3)萘普生不宜与小苏打同时服用的原因是___(用化学方程式表示)。
(4)X是D一种同分异构体,具有以下特点:
①萘的衍生物;②有两个取代基且在同一个苯环上;③在NaOH溶液中完全水解,含萘环的水解产物中有5种化学环境不同的氢。写出X可能的结构简式___。
(5)请用苯和CH3COCl为原料合成苯乙烯。(无机试剂任选)___。
(用合成路线流程图表示为:A![]() B…
B…![]() 目标产物)。
目标产物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,1molA和1molB进行反应:2A(g)+B(g)![]() 2C(g),达到平衡时生成0.6molC。下列说法正确的是( )
2C(g),达到平衡时生成0.6molC。下列说法正确的是( )
A.当容器内密度保持不变时,可以判断反应已达到平衡
B.其他条件不变,将容器体积变为5L,C的平衡浓度变为原来的2倍
C.达到平衡时,C的体积百分含量为0.353
D.其他条件不变,若增大压强,则物质A的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )

A. b电极是阴极B. a电极与电源的正极相连
C. 电解过程中水是氧化剂D. b电极附近溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
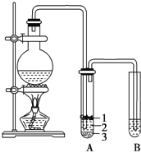
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇 和1:1的硫酸。配制体积比1:1的硫酸所用的仪器为 ________(选填编号)。
a 天平 b 量筒 c 容量瓶 d 烧杯
(2)写出加热时烧瓶中发生的主要反应的化学方程式 ___________________ 。
(3)将 生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________,试管A中的物质分为三层(如图所示),产物在第____层。
(4)试管A中除了产物和水之外,还可能存在 ________ ,_________ (写出结构简式)。
(5)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的最佳方法是 ___________(选填编号)。
a 蒸馏 b 氢氧化钠溶液洗涤 c 用四氯化碳萃取 d 用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质名称是_________。
(6)实验员老师建议把上述装置中的仪器连接部分由橡胶管改成标准玻璃接口,其原因_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com