
【题目】用下列装置进行相关实验,操作正确且能达到实验目的的是
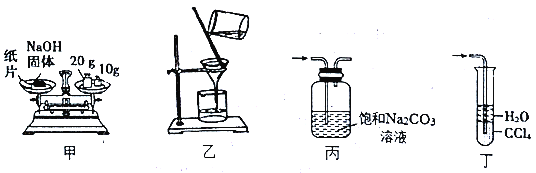
A. 甲装置:称30.0gNaOH固体 B. 乙装置:过滤除去溶液中的不溶性杂质
C. 丙装置:除去CO2中混有的HCl气体 D. 丁装置:吸收实验室制NH3的尾气
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是( )
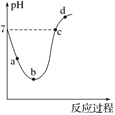
A. a点所示的溶液中c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
C. c点所示的溶液中c(Na+)=c(HClO)+c(ClO-)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是
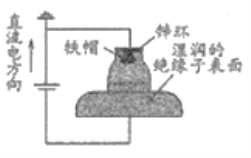
A. 通电时,锌环是阳极,发生氧化反应
B. 通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C. 断电时,锌环上的电极反应为Zn2++2e-=Zn
D. 断电时,仍能防止铁帽被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )

A.W、R元素单质分子内都存在非极性键
B.X、Z元素都能形成双原子分子
C.键长W—H<Y—H,键的极性Y—H>W—H
D.键长X—H<W—H,键能X—H<W—H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgO、Al2O3都是常用的耐火材料,某研究小组取100 kg含60%Al的报废汽车的镁合金材料来制备MgO、Al2O3,其中物质甲可由溶液B转化再生,其工艺流程如图所示。
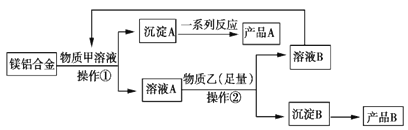
请回答下列问题:
(1)下列说法正确的是__________(填字母)。
A.合金是金属与金属熔合而成的混合物
B.合金的熔点比成分金属更高
C.合金的硬度等机械性能优于成分金属
D.氧化铝熔点高,故可以用氧化铝坩埚熔融氢氧化钠
(2)物质甲是________________,产品A是________________。
(3)操作②为____________。
(4)足量物质乙与溶液A发生反应的离子方程式为___________________________。
(5)假设不计损耗,可得产品B的质量为__________kg。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从实验测得不同物质中氧—氧之间的键长和键能的数据如下表:
O—O键 数据 | O | O | O2 | O |
键长/10-12m | 149 | 128 | 121 | 112 |
键能/kJ·mol-1 | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x。该规律性是( )
A. 成键时电子数越多,键能越大 B. 键长越短,键能越大
C. 成键所用的电子数越少,键能越小 D. 成键时电子对越偏移,键能越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:
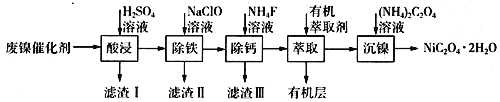
(1)请写出一种能提高“酸浸”速率的措施:________________________;滤渣I的成分是____________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
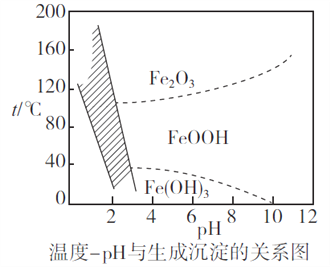
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________。
②该镀镍试剂的化学式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为: ____________________________,
Y元素原子最外层电子的电子排布图为:____________________________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为____(填“共价键”或“离子键”)。
(3)该化合物的空间结构为____,中心原子的杂化类型为____,分子为____(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____。
(5)该化合物的沸点与SiCl4比较:____(填化学式)的高,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是 ( )
A. 盐酸溶液加到氢氧化铁中:Fe(OH)3+3H+===Fe3++3H2O
B. 硫酸与氢氧化钡溶液反应:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
C. CuSO4溶液与氨水反应:Cu2++2NH3·H2O===Cu(OH)2↓+2NH。
D. 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-===CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com