
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示
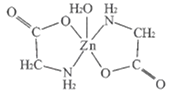
(1)基态Zn2+核外价电子排布图为_____;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的排列顺序为_____。
(2)甘氨酸(H2N-CH2-COOH)的羧基中C原子的杂化轨道类型为_____;甘氨酸易溶于水,试从结构角度解释:_____。
(3)以氧化锌矿物为原料,提取锌的过程中涉及反应:Zn+2NH3+ 2NH4+= [Zn(NH3)4]2++H2O。与NH4+互为等电子体的阴离子为_____(写岀1种即可);[Zn(NH3)4]2+ 离子结构示意图:____________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1mol IMI中含有_____个σ键;常温下IMI的某种衍生物与甘氨酸形成的离子化合物
,则1mol IMI中含有_____个σ键;常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态,其原因是_____。
为液态而非固态,其原因是_____。
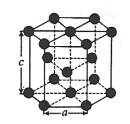
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为 _____;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,则Zn的密度为_____gcm-3(列出算式即可)。
【答案】![]() O>N>C>H sp2 甘氨酸为极性分子,且分子中的氨基和羧基都能与水分子形成氢键 BH4-或AlH4-
O>N>C>H sp2 甘氨酸为极性分子,且分子中的氨基和羧基都能与水分子形成氢键 BH4-或AlH4-  7.22×1024 该化合物中阴、阳离子的体积大,且所带电荷少,从而形成的离子晶体晶格能小,熔点低 六方最密堆积
7.22×1024 该化合物中阴、阳离子的体积大,且所带电荷少,从而形成的离子晶体晶格能小,熔点低 六方最密堆积 
【解析】
(1)基态Zn2+的价电子为其3d能级上的10个电子;一水合甘氨酸锌中所涉及的非金属元素有C、O、N、H元素,元素的非金属性越强,其电负性越大;
(2)甘氨酸(H2N-CH2-COOH)中亚甲基上C原子和N原子价层电子对个数都是4、羧基上的C原子价层电子对个数是3,根据价层电子对互斥理论判断C、N原子的杂化轨道类型;甘氨酸为极性分子,且氨基和羧基都能和水分子形成分子间氢键;
(3)等电子体是含有原子数目相同,价电子总数相等的微粒;
(4)1个IMI中含有12个σ键;离子晶体的晶格能影响其熔沸点,其晶格能越小熔沸点越低;
(5)金属锌的这种堆积方式称为六方最密堆积,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=![]() 。
。
(1)基态Zn2+的价电子为其3d能级上的10个电子,其价电子排布图为![]() ;一水合甘氨酸锌中所涉及的非金属元素有C.O、N、H元素,元素的非金属性越强,其电负性越大,非金属性大小顺序为O>N>C>H,则电负性大小顺序为O>N>C>H,
;一水合甘氨酸锌中所涉及的非金属元素有C.O、N、H元素,元素的非金属性越强,其电负性越大,非金属性大小顺序为O>N>C>H,则电负性大小顺序为O>N>C>H,
故答案为:![]() ;O>N>C>H;
;O>N>C>H;
(2)甘氨酸(H2NCH2COOH)中亚甲基上C原子和N原子价层电子对个数都是4、羧基上的C原子价层电子对个数是3,根据价层电子对互斥理论,亚甲基上碳原子和N原子采用sp3杂化、羧基上的C原子采用sp2杂化;甘氨酸为极性分子,且氨基和羧基都能和水分子形成分子间氢键,导致甘氨酸易溶于水,
故答案为:sp2;甘氨酸为极性分子,且氨基和羧基都能和水分子形成分子间氢键;
(3) 根据等电子体原理,与NH4+互为等电子体的阴离子为BH4-或AlH4-,[Zn(NH3)4]2+ 离子结构示意图:
故答案为:BH4-或AlH4-; ;
;
(4)1个IMI中含有12个σ键,则IMI中含有12NA个σ键,即是7.22×1024;离子晶体的晶格能影响其熔沸点,其晶格能越小熔沸点越低,该化合物中阴、阳离子的体积大,且所带电荷少,从而形成的离子晶体晶格能小,熔点低,
故答案为:7.22×1024;该化合物中阴、阳离子的体积大,且所带电荷少,从而形成的离子晶体晶格能小,熔点低;
(5)金属锌的这种堆积方式称为六方最密堆积,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3=a2c×
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3=a2c×![]() ,晶胞的质量span>m=
,晶胞的质量span>m=![]() ,晶胞密度=
,晶胞密度= ,故答案为:六方最密堆积;
,故答案为:六方最密堆积;  。
。


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】硫酸铅( PbSO4) 广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为 PbS, 含有FeS2等杂质)和软锰矿(主要成分为MnO2 ) 制备PbSO4的工艺流程如图:

已知:
i. PbCl2难溶于冷水,易溶于热水
ii. PbCl2 (s) + 2 Cl- ( aq ) ![]() PbCl42-( aq ) △H> 0
PbCl42-( aq ) △H> 0
iii.Ksp(PbSO4) =1. 08 ×10-8 , Ksp(PbC12) = 1. 6× 10 -5
(1)“浸取”过程中盐酸与MnO2 、P bS 发生反应生成PbCl2和S 的化学方程式为______________,加入NaCl 的目的是__________________。
(2)沉降操作时加入冰水的作用是_______________________。
(3) 20°C 时 ,PbCl2 ( s) 在不同浓度盐酸中的最大溶解量( g L-1 ) 如图所示。下列叙述正确的是_____________(填字母)

A. 盐酸浓度越小,Ksp(PbC12)越小
B.x、y 两点对应的溶液中c( Pb2+ )不相等
C 当盐酸浓度为1 mol L-1 时,溶液中c( Pb2+)一定最小
D. 当盐酸浓度小于1 mol L-1时 ,随 HCl 浓度增大,P bCl2 溶解量减少是因为 Cl-浓度增大使 PbCl2溶解平衡逆向移动
(4)调 pH 的目的是__________,PbC12 “转化”后得到 PbSO4, 当c (Cl-)= 0.100mol/L 时 ,c( SO42-) =________________。
(5)滤液 a 经过处理后可以返回到______工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂--三盐基硫酸 (3 PbOPbSO4H2O) ,写出该反应的化学方程式 _____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
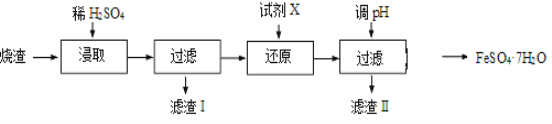
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为__________________。能提高烧渣浸取速率的措施有__________________(填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
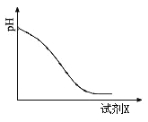
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是________(填字母)。还原结束时,溶液中的主要阴离子有_____________。
A.Fe粉 B.SO2 C.NaI
(3)滤渣Ⅱ主要成分的化学式为__________________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_______________________________ 、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。

(1) Na2MoO42H2O中钼元素的化合价是_____;在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是_____
(2)“焙烧”时MoS2转化为MoO3,写出该反应的化学方程式:_____,反应中氧化产物是_____(填化学式)。
(3)“浸取”时含钼化合物发生反应的离子方程式为___________;“结晶”前需向滤液中加入Ba(OH)2固体以除去CO32-。若滤液中c(MoO42-)= 0.40 mol L-1,c(CO32-)= 0.10 molL-1,当BaMoO4开始沉淀时,CO32-的去除率是_____% [已知:Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4.0×l0-8]。
(4)“分析纯”的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与流程中所产生的气体一起通入水中,得到正盐的化学式为_____。
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____
②碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL FeI2溶液中逐渐通入C12,其中n(I2)、n(Fe3+)随通入n(C12)的变化如图所示,下列说法不正确的是
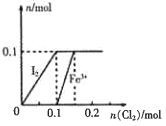
A. 氧化性强弱:I2<Fe3+
B. n(Cl2)=0.12mol时,溶液中的离子主要有Fe2+、Fe3+、Clˉ
C. 由图可知,该FeI2溶液的浓度为1mol· L-l
D. n(C12):n(FeI2)=1:2时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
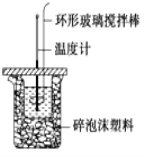
①用量筒量取50mL 0.50molL-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;
②用另一量筒量取50mL 0.55molL-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)实验中NaOH溶液稍稍过量的目的是_________________________________________。
(2)使盐酸与NaOH溶液混合均匀的正确操作是_______(填序号).
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)实验中改用60mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液进行反应,与上述实验相比,放出的热量______________(填“ 偏多”“偏少”或“相等”,下同),所求得的中和热ΔH ______________。
(4)如果上述实验测得中和热ΔH = -55.6kJ/mol,并已知:Ba2+(aq)+2OH-(aq)+ 2H++SO42- (aq)=BaSO4(s) +2H2O(l) ,ΔH=-1584.2 kJ·mol-1。则生成BaSO4(s)的反应热ΔH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是( )
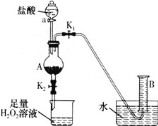
A.烧杯中H2O2溶液的作用是将Fe2+氧化为Fe3+
B.A中存在氧化铁与盐酸反应生成氯化铁的反应
C.利用B装置不能准确测量生成氢气的体积
D.将反应后的溶液放入烧杯中再通入少量SO2,则溶液颜色立即由棕黄色变为浅绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是( )

A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com