
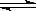 W��s��+3 H2O��g��
W��s��+3 H2O��g��| �¶� | 25 �� ~ 550 �� ~ 600�� ~ 700�� |
| ��Ҫ�ɷ� | WO3 W2O5 WO2 W |
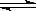 W��s��+2H2O��g�� ��H��+66 kJ·mol-1
W��s��+2H2O��g�� ��H��+66 kJ·mol-1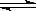 W��s��+2H2O��g�� ��H�� ��137.9 kJ·mol-1
W��s��+2H2O��g�� ��H�� ��137.9 kJ·mol-1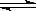 WO2��g���Ħ�H��_____ _______.
WO2��g���Ħ�H��_____ _______.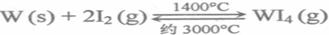
 W2O5+H2O�� W2O5 , WO2
W2O5+H2O�� W2O5 , WO2 W2O5��H2O��ͬ�����ݱ��е����ݿ�֪��580��ʱ���������ʵ���Ҫ�ɷ�ΪW2O5�� WO2��
W2O5��H2O��ͬ�����ݱ��е����ݿ�֪��580��ʱ���������ʵ���Ҫ�ɷ�ΪW2O5�� WO2��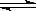 WO2��g�������Ԧ�H����66kJ/mol��137.9kJ/mol����203.9kJ/mol��
WO2��g�������Ԧ�H����66kJ/mol��137.9kJ/mol����203.9kJ/mol��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)����H��0��ƽ���ƶ���ϵ��ͼ��ʾ������˵����ȷ���ǣ��� ��
2C(g)����H��0��ƽ���ƶ���ϵ��ͼ��ʾ������˵����ȷ���ǣ��� ��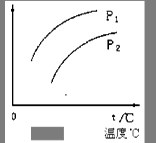
| A��P1��P2��������ָA���������� |
| B��P1�� P2��������ָC���������� |
| C��P1�� P2��������ָA��ת���� |
| D��P1�� P2��������ָ��������ƽ��Ħ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
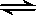 2NH3(g)������Ӧ������n(H2)��n(NH3)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ���������й���������ȷ����
2NH3(g)������Ӧ������n(H2)��n(NH3)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ���������й���������ȷ����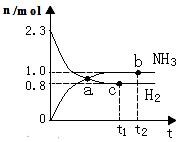
| A��a���ʾNH3����������NH3�ֽ�������� |
| B��b��H2��ת���ʴ���c�� |
| C������t1ʱ���ٳ���һ����ϡ�����壬�ﵽ��ƽ��ʱn (H2������0.8mol |
| D������t2ʱ���ٳ���һ����NH3(g)���ﵽ��ƽ��ʱNH3����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A������ӦΪ���ȷ�Ӧ | B������ӦΪ���ȷ�Ӧ |
| C�����º�CO��Ũ������ | D�����º�����ʵ�Ũ�Ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2 + H2����830K�¶��´ﵽƽ�⡣
CO2 + H2����830K�¶��´ﵽƽ�⡣�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
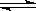 2HI(g)
2HI(g)  H��0�� �ﵽƽ����ı��������������Ũ�ȡ���ϵѹǿ�ȶ�����������Ŀ�ı仯ʱ������Ϊƽ��һ���������ƶ��ı�־���ǣ� ��
H��0�� �ﵽƽ����ı��������������Ũ�ȡ���ϵѹǿ�ȶ�����������Ŀ�ı仯ʱ������Ϊƽ��һ���������ƶ��ı�־���ǣ� �� | A��������ܶȱ�С�� | B����Ӧ���������Ũ�Ⱦ���Ϊԭ����2�� |
| C���������ɫ������ | D����ϵ���¶ȷ����˱仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
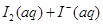

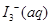 ijI2����KI�����Һ�У�
ijI2����KI�����Һ�У�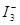 �����ʵ���Ũ��c(
�����ʵ���Ũ��c(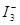 )���¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ����
)���¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ����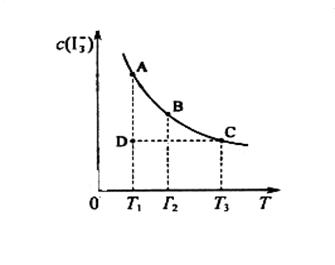
A����Ӧ 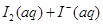  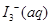 ��H>0 ��H>0 |
B�����¶�Ϊ ����Ӧ��ƽ�ⳣ���ֱ�Ϊ ����Ӧ��ƽ�ⳣ���ֱ�Ϊ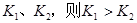 |
C������Ӧ���е�״̬Dʱ�� |
| D��״̬A��״̬B��ȣ�״̬A��c(I2)�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO(g)+H2O(g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���| t���棩 | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 4NO(g)+6H2O(g) ��H��0���˷�Ӧ��ʼ�����ʵ�����ͬ�������й�ϵͼ��ȷ����
4NO(g)+6H2O(g) ��H��0���˷�Ӧ��ʼ�����ʵ�����ͬ�������й�ϵͼ��ȷ����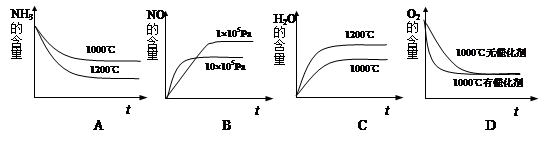
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com