
(1)在饱和Na2CO3溶液中通入足量的CO2气体,会有晶体析出,此晶体是_________。析出晶体的原因有:①___________,②_____________,③_________________。
(2)向Na2CO3溶液中逐滴滴入稀盐酸,溶液中的![]() 浓度的变化情况是_____________。
浓度的变化情况是_____________。
A.逐渐增大 B.逐渐变小
C.先逐渐增大而后减小 D.先逐渐减小后变大
试用离子方程式和简要文字说明理由______________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
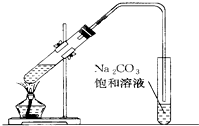 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)向Na2CO3溶液中逐滴滴入稀盐酸,溶液中的![]() 浓度的变化情况是_____________。
浓度的变化情况是_____________。
A.逐渐增大 B.逐渐变小
C.先逐渐增大而后减小 D.先逐渐减小后变大
试用离子方程式和简要文字说明理由______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com