

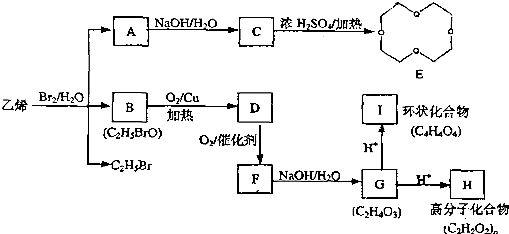
 .请回答下列问题:
.请回答下列问题: ,E为
,E为 ,D的分子式是C6H5O3N(含2种含氧官能团),结合信息②可知,D为
,D的分子式是C6H5O3N(含2种含氧官能团),结合信息②可知,D为 ,由转化关系可知B中含有硝基,苯与氯气发生取代反应生成A,A与试剂X反应得到B,则B中含有氯原子、硝基,且处于对位,故B为
,由转化关系可知B中含有硝基,苯与氯气发生取代反应生成A,A与试剂X反应得到B,则B中含有氯原子、硝基,且处于对位,故B为 ,A为
,A为 ,A→B引入硝基,必有硝酸参与反应,还需浓硫酸做催化剂,B发生水解反应生成C,C与HCl反应生成D,故C为
,A→B引入硝基,必有硝酸参与反应,还需浓硫酸做催化剂,B发生水解反应生成C,C与HCl反应生成D,故C为 ,据此解答.
,据此解答. ,E为
,E为 ,D的分子式是C6H5O3N(含2种含氧官能团),结合信息②可知,D为
,D的分子式是C6H5O3N(含2种含氧官能团),结合信息②可知,D为 ,由转化关系可知B中含有硝基,苯与氯气发生取代反应生成A,A与试剂X反应得到B,则B中含有氯原子、硝基,且处于对位,故B为
,由转化关系可知B中含有硝基,苯与氯气发生取代反应生成A,A与试剂X反应得到B,则B中含有氯原子、硝基,且处于对位,故B为 ,A为
,A为 ,A→B引入硝基,必有硝酸参与反应,还需浓硫酸做催化剂,B发生水解反应生成C,C与HCl反应生成D,故C为
,A→B引入硝基,必有硝酸参与反应,还需浓硫酸做催化剂,B发生水解反应生成C,C与HCl反应生成D,故C为 ,
, ,
, ;
; ,故答案为:
,故答案为: ;
; )的同分异构体同时符合下列条件:属酚类化合物,且苯环上有三种不同化学环境的氢原子;能发生银镜反应,含有醛基或甲酸形成的酯基,符合条件的2种同分异构体为:
)的同分异构体同时符合下列条件:属酚类化合物,且苯环上有三种不同化学环境的氢原子;能发生银镜反应,含有醛基或甲酸形成的酯基,符合条件的2种同分异构体为: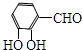 、
、 等,故答案为:
等,故答案为: ;
; .
.


科目:高中化学 来源: 题型:
| A、HCl+Na2CO3,HCl+NaHCO3 |
| B、HCl+Na2CO3,HNO3+K2CO3 |
| C、H2SO4+Ba(OH)2,H2SO4+KOH |
| D、BaCl2+Na2SO4,BaCO3+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,3.0g甲醛(CH2O)和冰醋酸(C2H4O2)的混合物中含有的原子总数为0.4NA |
| B、在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023 |
| C、500mL1mol/L的Na2SO4溶液中,Na+和SO42-离子总数为6.02×1023 |
| D、标准状况下,1molCCL4的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
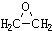 )的结构可简写为
)的结构可简写为 ,则E的分子式是
,则E的分子式是查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | HI | H2 | I2 |
| 浓度/(mol?L-1) | 0.40 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量时,将NaOH固体直接放在天平托盘上面的纸上 |
| B、将称好的NaOH固体直接放入容量瓶中,加入少量水溶解 |
| C、在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中 |
| D、将烧杯中已冷却的NaOH溶液注入容量瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com