
有关如图所示化合物的说法不正确的是( )
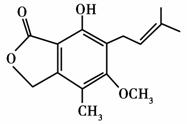
A.该有机物的分子式为C15H18O4
B.1 mol该化合物最多可以与2 mol NaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
科目:高中化学 来源: 题型:
下列实验的现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 硫化钠与亚硫酸钠溶液混合 | 产生黄色沉淀 | S2-有还原性与SO32-有氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| D | 二氧化硫通入紫色石蕊溶液中 | 紫色褪去 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应H2 + Cl2 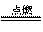 2HCl,下列说法正确的是:( )
2HCl,下列说法正确的是:( )
A.该反应中,化学能只有转变为热能
B.反应物所具有的总能量高于产物所具有的总能量
C.断开1mol H—H键和1mol Cl—Cl键所吸收的总能量小于形成1mol H—Cl键所放出的能量
D.产物所具有的总能量高于反应物所具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
现有如下两个反应:
A.NaOH + HCl = NaCl + H2O
B.2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质,能设计成原电池的是:__________(选择“A”或“B”) (1分);
(2)如果可以, 写出负极电极反应式:_______________,电解质溶液:____________;
(3)由第(2)小题可知:一个完整有氧化还原反应方程式可拆写成两个“半反应式”,一个是氧化反应式,一个是还原反应式,并由此实现了化学能与电能的相互转化;则3NO2+H2O = 2H++2NO3-+NO反应的氧化反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种碳架结构如下的烃,下列描述不正确的是( )

A.a和d互为同分异构体
B.b和c是同系物
C.a和d都能发生加成反应
D.b、c、d都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是( )
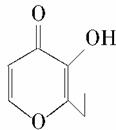
A.该有机物的分子式为C7H7O3
B.该有机物能发生取代、加成和氧化反应
C.1 mol该有机物最多能与2 mol H2发生加成反应
D.该有机物的一种芳香族同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
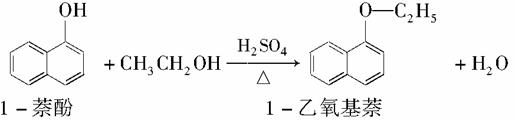
已知:①相关物质的物理常数如下。
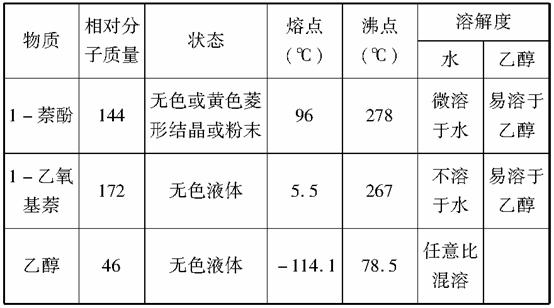
②1-萘酚的性质与苯酚相似,有难闻的苯酚气味,苯酚在空气中易被氧化为粉红色。
请回答以下问题:
(1)将72 g 1-萘酚溶于100 mL无水乙醇中,加入5 mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是___________________________________________。
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是________________(填序号)。
A.③②④① B.①②③④ C.②①③④
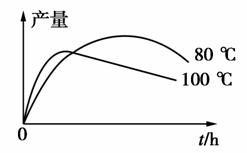
(3)实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高,1-乙氧基萘的产量下降的原因可能是________________。
(4)提纯的产品经测定为43 g,本实验中1-乙氧基萘的产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钛被称为“21世纪金属”,是研制卫星、火箭、宇宙飞船及深海潜艇的重要材料。研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置模拟获得金属钙(需定期更换石墨棒),并以钙为还原剂,还原二氧化钛制备金属钛。下列叙述正确的是( )
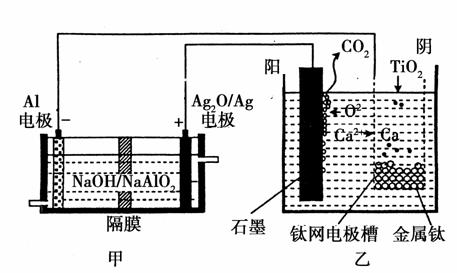
A.甲装置工作过程中OH-向Ag2O/Ag极移动,乙装置工作过程中O2-向阴极移动
B.若电解金属Ti效率为η,则制备1 mol Ti时消耗Al的物质的量为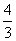 (1-η) mol
(1-η) mol
C.乙装置阳极的电极反应式为C+2O2--4e-===CO2↑
D.在制备金属钛前后,整套装置中CaO的总量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并
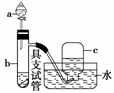 观察还原产物的实验装置。
观察还原产物的实验装置。
Ⅰ.浓硝酸的强氧化性实验
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:______________________________________
________________________________________________________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象
________________________________________________________________________
________________________________________________________________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是________________________________________________________________________
________________________________________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是______________________________
(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是________________________________________________________________________
________________________________________________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com