
【题目】你认为减少酸雨产生可采用的措施是( )
①少用煤作燃料 ②把工厂烟囱加高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③B.②③④⑤
C.①③⑤D.①③④⑤
科目:高中化学 来源: 题型:
【题目】小明同学设计了如图所示装置来探究铜跟浓硫酸的反应及气体收集。
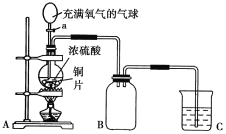
先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余。再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失。
(1)请写出上述过程A装置中所涉及的化学反应方程式
______________________________________________________________;
(2)张老师认为实验中B装置设计有误,请你帮助小明在装置中进行修改___________。
(3)B装置中所收集到的气体既具有氧化性又具有还原性,请写出一个体现其还原性的化学方程式:______________________,为了验证其漂白性,还可将其通入______试液进行观察。
(4)装置C中应盛放的试剂为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(Lmin)。
xC(g)+2D(g),5min 后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(Lmin)。
(1)B的反应速率v(B)=_____________,X=_____。
(2)A在5min末的浓度是________________。
(3)此时容器内的压强与开始时之比为_________。
Ⅱ.(4)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________;
b.指出它分子内的键型_________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:

(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。_______________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:_____________________________。
②过滤:_____________________________。
③蒸发:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国在航空航天事业上取得了令人瞩目的成就,科学家在能量的转化,航天器的零排放作出了很大的努力,其中为了达到零排放的要求,循环利用人体呼出的CO2并提供O2,设计了一种装置(如图)实现了能量的转化,总反应方程式为2CO2=2CO+O2。关于该装置下列说法正确的是( )

A. 装置中离子交换膜为阳离子交换膜
B. 反应完毕,电解质溶液碱性减弱
C. N型半导体为阳极,P型半导体为阴极
D. CO2参与X电极的反应方程式:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存而且为无色透明的溶液是( )
A.NH4+、Al3+、SO42﹣、NO3﹣
B.K+、Na+、NO3﹣、CO32﹣
C.K+、MnO4﹣、NH4+、NO3﹣
D.H+ , K+ , OH﹣ , NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①25 ℃时,弱电解质的电离平衡常数:K(CH3COOH)=1.8×10-5,K(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=6×10-10。②25 ℃时,2.0×10-3 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
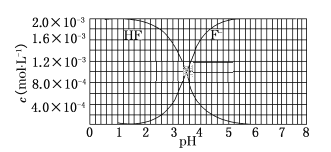

请根据以上信息回答下列问题:
(1)25 ℃时,将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L HSCN溶液分别与20 mL 0.10 mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是__________,反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)。
(2)25 ℃时,HF电离平衡常数的数值Ka≈______。
(3)4.0×10-3 mol/L HF溶液与4.0×10-4mol/L CaCl2溶液等体积混合,调节混合液pH为4.0后(忽略调节时混合液体积的变化),_______沉淀产生。(填“有”或“无”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,加入0.100 molCO气体和0.080 molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=________。
(2)计算此反应在800C时的化学平衡常数k=______________。若向平衡后的体系中加入CO和CO2各0.05mol,则此时v(正)_______v (逆) 。
(3)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:C(s)+O2(g)![]() CO2(g) H =-393.5 kJ/mol,2CO(g)+ O2(g)
CO2(g) H =-393.5 kJ/mol,2CO(g)+ O2(g)![]() 2CO2(g) H=-566 kJ/mol,2H2(g)+ O2(g)
2CO2(g) H=-566 kJ/mol,2H2(g)+ O2(g)![]() 2H2O(g) H =-571.6 kJ/mol,则C(s)+H2O(g)
2H2O(g) H =-571.6 kJ/mol,则C(s)+H2O(g)![]() CO(g)+H2(g) H = __________。此反应的化学平衡表达式为:_______________________。
CO(g)+H2(g) H = __________。此反应的化学平衡表达式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一10 L的密闭容器中充入SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。测得4 min内,O2的物质的量由开始的18 mol降到14 mol,再过t min,O2的物质的量变为10 mol。求:
2SO3(g)。测得4 min内,O2的物质的量由开始的18 mol降到14 mol,再过t min,O2的物质的量变为10 mol。求:
(1)4 min末SO3的浓度。
(2)4 min内用SO2表示的反应速率。
(3)t (填“>”“<”或“=”)4 min,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com