
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是

A.当y(NaOH)=20 mL时,溶液中离子浓度大小关系:
c(Na+) >c(HA一)>c(H+)> c(A2- )>c(OH—)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加入水的过程中,pH可能增大也可能减小
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2012-2013学年广东省汕头市高三上学期第三次调研考试化学试卷(解析版) 题型:选择题
(双选)常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法正确的是

A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三4月双周练习化学试卷(解析版) 题型:选择题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法正确的是
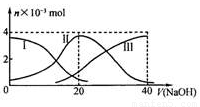
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA¯)>c(H+)> c(A2-)>c(OH¯)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中 水的电离程度比纯水的大
C.NaHA溶液中:c(OH—)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省高三下学期期中考试化学试卷 题型:选择题
常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中正确的是
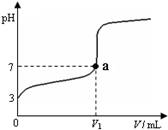
A.上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1
B.图中V1 >20 mL
C.a点对应的溶液中:c (CH3COO-)=c (Na+)
D.当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省成都市高三第一次诊断性检测(理综)化学部分 题型:选择题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断,下列说法正确的是 ( )
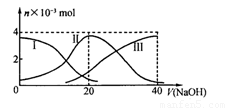
A.当y (NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>cHA一)>c(H+)>
c(A2->c(OH—)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加入水的过程中,pH可能增大也可能减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com