
| A. | $\frac{5a+10}{3a+5}$mol | B. | $\frac{3a+5}{5a+10}$mol | C. | $\frac{5}{9a+15}$mol | D. | $\frac{9a+15}{5}$mol |
分析 当溶液中I-和I2的物质的量之比为a:1时,设I2的物质的量为xmol,则
配平:IO3-+3HSO3-=I-+3SO42-+3H+反应①
5x+3ax 15x+9ax 5x+3ax
IO3-+5I-+6H+=3I2+3H2O 反应②
x 5x 3x
所以15x+9ax=5mol,由此分析解答.
解答 解:当溶液中I-和I2的物质的量之比为a:1时,设I2的物质的量为xmol,则
配平:IO3-+3HSO3-=I-+3SO42-+3H+反应①
5x+3ax 15x+9ax 5x+3ax
IO3-+5I-+6H+=3I2+3H2O 反应②
x 5x 3x
所以15x+9ax=5mol,解之得:x=$\frac{5}{15+9a}$mol,所以NaIO3的物质的量是6x+3ax=$\frac{5a+10}{3a+5}$mol,
故选A.
点评 本题是一道有关氧化还原反应的综合题,考查角度广,要求学生具有分析和解决问题的能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| B. | 纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 | |
| C. | 已知工业合成氨△H<O,达平衡后,升高温度,正反应速率减少、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | NH3(g)+HCl(g)═NH4Cl(s)较低温下能自发进行,说明该反应的△H<O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的摩尔质量是40 g | |
| B. | 1 mol硫酸的质量是98g•mol-1 | |
| C. | 甲烷的摩尔质量就是它的相对分子质量 | |
| D. | 17 g NH3含N原子数是6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
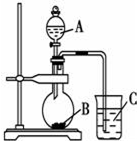 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向稀H2SO4中加入过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 向AlCl3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com