
| A. | 非金属性 Z>Y>X | B. | 原子半径 X>Y>Z | ||
| C. | 气态氢化物的稳定性 X>Y>Z | D. | 原子最外层电子数Z>Y>X |
分析 元素的非金属性越强,其最高价氧化物的水化物酸性越强,同一周期元素,元素的非金属性随着原子序数的增大而增强,同周期的X、Y、Z三种元素,最高价氧化物的水化物酸性由强到弱顺序为HXO4>H2YO4>H3ZO4,则原子序数X>Y>Z,再结合元素周期律分析解答.
解答 解:元素的非金属性越强,其最高价氧化物的水化物酸性越强,同一周期元素,元素的非金属性随着原子序数的增大而增强,同周期的X、Y、Z三种元素,最高价氧化物的水化物酸性由强到弱顺序为HXO4>H2YO4>H3ZO4,则原子序数X>Y>Z,
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以非金属性X>Y>Z,故A错误;
B.通过以上分析知,原子序数X>Y>Z,同周期原子序数大的原子半径小,则原子半径为X<Y<Z,故B错误;
C.元素的非金属性越强,其氢化物越稳定,非金属性X>Y>Z,气态氢化物的稳定性:HX>H2Y>ZH3,故C正确;
D.同一周期元素,原子序数X>Y>Z,最外层电子数随原子序数增大而增大,原子最外层电子数X>Y>Z,故D错误;
故选C.
点评 本题考查位置结构性质的相互关系及应用,为高频考点,把握元素的位置和性质、元素周期律为解答的关键,注意同周期元素性质的递变规律,题目难度中等.


科目:高中化学 来源: 题型:解答题
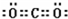 ;E的单质在空气中燃烧所生成物质的化学式SO2.
;E的单质在空气中燃烧所生成物质的化学式SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的氯原子${\;}_{17}^{37}$Cl | B. | 硫离子的结构示意图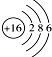 | ||
| C. | 过氧化钠的电子式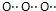 | D. | HClO的结构式H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol | |
| B. | 若P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol,则红磷比白磷稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| B. | 1 mol甲苯能与3 mol H2发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾褪色 | |
| D. | 甲苯能燃烧产生带浓烟的火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为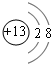 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
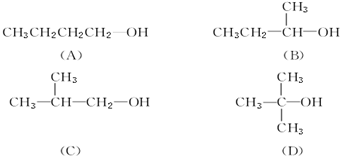
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
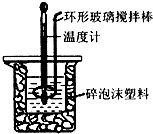 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构.下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 单质的活泼性:a>c>d | ||
| C. | 原子半径:c>a>d | D. | 最高价含氧酸的酸性:d>c>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com