
【题目】25℃时,重水(D2O)的离子积为 1.6×10ˉ15,也可用与 pH 一样的定义来规定其酸碱度:pD=-lgc(D+),下列叙述正确的是(均为 25℃条件下)
A.重水和水两种液体,D2O 的电离度大于 H2O
B.在 100mL0.25mol·Lˉ1DCl 重水溶液中,加入 50mL0.2mol·Lˉ1NaOD 重水溶液,反应后溶液的 pD=1
C.0.01 mol·Lˉ1NaOD 重水溶液,其 pD=12
D.NH4Cl 溶于 D2O 中生成的一水合氨和水合氢离子的化学式为 NH3·D2O 和 HD2O+
【答案】B
【解析】
A.重水和水两种液体,化学性质相似,D2O 的电离度等于 H2O的电离度,故A错误;
B.根据中和反应量的关系,100mL 0.25mol·L-1 DCl和50mL 0.2mol·L-1 NaOD中和后溶液中DCl过量,剩余DCl浓度为![]() =0.1mol·L-1,则c(D+)=0.1mol·L-1,故pD=-lgc(D+)=-lg0.1=1,故B正确;
=0.1mol·L-1,则c(D+)=0.1mol·L-1,故pD=-lgc(D+)=-lg0.1=1,故B正确;
C.在1LD2O中,溶解0.01molNaOD,则溶液中c(OD-)=0.01mol·L-1,根据重水离子积常数,可知c(D+)=![]() mol·L-1=1.6×10-13mol·L-1,pD=-lgc(D+)=-lg1.6×10-13=13-lg1.6≠12,故C错误;
mol·L-1=1.6×10-13mol·L-1,pD=-lgc(D+)=-lg1.6×10-13=13-lg1.6≠12,故C错误;
D.NH4Cl 溶于 D2O 中生成的一水合氨和水合氢离子的化学式为 NH3·DHO 和 D3O+,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E都含另外同一种元素。请回答:
(1)A是__________,Y是__________,Z是__________。
(2)当X是强酸时,E是__________;B生成C的化学方程式是________________________。
(3)当X是强碱时,E是__________; B生成C的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的A为直流电源,B为渗透饱和氯化钠溶液和酚酞溶液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色。请填空:
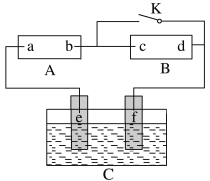
(1)电源A中a点为________极。
(2)滤纸B上发生氧化反应的电极反应方程式为:____________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路:
①电极e上发生的反应为:__________________;
②在此过程中电解液的浓度(填“始终不变”、“略微增大”、“略微减小”)___________;
③电镀槽中盛放的电镀液可以是________或________(只要求填两种电解质溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D.P-P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
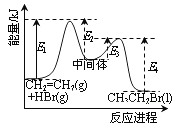
A. 分子式为C2H4O的有机化合物性质相同
B. 同温同压下,同体积的任何气体均含有相同的原子数
C. 密闭容器中1molN2与3molH2充分反应,产物的分子数为 2×6.02×1023
D. 依据右图能量曲线可确定反应:CH2=CH2(g)+HBr(g)→CH3CH2Br(l)的![]() H= (E1+E3-E2-E4)kJ·mol-1
H= (E1+E3-E2-E4)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4、NaOH混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )

A. 0.100 mol·L-1NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
B. Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
C. P点:c(Na+)+c(H2C2O4)<0.100mol·L-1+c(C2O42-)
D. 该温度下H2C2O4的电离常数Ka2=1×10-4.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com