

分析 ①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和;
②NO被CO还原,则CO被NO氧化生成二氧化碳和氮气,据此写出反应方程式;
③根据G=△H-T•△S判断反应能否自发进行;
解答 解:①该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,故答案为:+183 kJ/mol;
②在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
故答案为:2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
③2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现,
故答案为:该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0,不能实现.
点评 本题较为综合,涉及热化学反应方程式、化学反应方程式的书写和反应的自发性等知识点,注意反应热的计算方法,为易错点.


科目:高中化学 来源: 题型:选择题
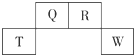 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3,下列说法正确的是( )| A. | Q的最高价氧化物对应水化物的酸性大于R的最高价氧化物对应水化物的酸性 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | 元素T形成单质的还原性大于元素W形成单质的还原性 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ③④ | C. | ①②⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO、Al2O3熔点高,可用于耐火材料 | |
| B. | Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂 | |
| C. | SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色 | |
| D. | 常温下,铝与浓硝酸发生钝化,可用铝罐车贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 45.8 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 452 | 488 | 614 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2 CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | Ag++Cl-═AgCl↓ AgNO3+NaCl═AgCl↓+NaNO3 | |
| D. | Cu+2Ag+═Cu2++2Ag↓ Cu+2AgCl═2Ag+CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com