
【题目】甲醇又称“木精”,是非常重要的化工原料。
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇。根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式______。
化学键 | H-H | O-H | C-H | C-O | C=O |
键能/KJ·mol-1 | 436 | 463 | 413 | 351 | 1076 |
(2)甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。

①该脱氢反应的ΔH___0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判断依据是_____
③下列叙述不能说明该脱氢反应已经达到平衡状态的是_____。
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸。已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13。
常温下,将20mL0.10mol·L-1CH3COOH溶液和20mL0.10mol·L-1HSCN溶液分别与20mL0.10mol·L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如下图所示:

①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是_______,反应结束后所得两溶液中,C(CH3COO-)____ c(SCN-)(填“>”、“<”或“=”)。
②常温条件下,将amol·L-1的CH3COOH与bmol·L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_______。
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体电极的电极反应式为___________。

【答案】 CO(g)+2H2 (g) → CH3OH(g) △H =-105 kJ·mol─1 > 由图像看出,升温,CH3OH转化率增大,平衡向正向移动,正向为吸热反应 < A c(HSCN)=c(CH3COOH)时,HSCN溶液中c(H+)较大,故其溶液与NaHCO3溶液反应速率较快 < ![]() CH3OH-6e-+H2O=CO2+6H+
CH3OH-6e-+H2O=CO2+6H+
【解析】(1)考查热化学反应方程式的计算,目标反应是CO+2H2=CH3OH,根据△H=反应物键能总和-生成物键能总和=[1076+2×436-(3×413+351+463)]kJ·mol-1=-105kJ·mol-1,热化学反应方程式为:CO(g)+2H2 (g) = CH3OH(g) △H =-105 kJ·mol─1;(2)考查影响化学平衡移动的因素、化学平衡状态的判断,①根据图像,随着温度升高,甲醇的转化率增大,说明反应向正反应方向进行,即正反应是吸热反应,△H>0;②曲线上的每一个点达到平衡,Y→X点,甲醇的转化率降低,说明反应向逆反应方向进行,即v(逆)>v(正);③A、题目中没有说明开始时甲醇的通入量和转化率,因此c(CH3COH)=c(HCHO),无法判断是否达到平衡,故A说法错误;B、根据化学平衡状态的定义,当体积分数不再改变,说明反应达到平衡,故B说法正确;C、用不同物质的反应速率表示,首先是反应方向是一正一逆,v正(CH3OH)说明反应向正反应方向进行,v逆(HCHO)反应向逆反应方向进行,然后速率之比等于化学计量数之比,因此当V正(CH3OH)=V逆(HCHO),说明反应达到平衡,故C说法正确;D、根据M=m/n,组分都是气体,因此气体质量保持不变,反应前气体系数之和小于反应后气体系数,即气体物质的量增大,因此有当平均摩尔质量保持不变,说明反应达到平衡,故D说法正确;(3)考查电离平衡常数、弱电解质的电离和盐类水解,①根据电离平衡常数的意义,电离平衡常数越大,说明酸性或碱性越强,即HSCN的酸性强于CH3COOH,当两者浓度相等时,HSCN溶液中c(H+)大于CH3COOH,因此开始时HSCN反应速率快;两者恰好完全反应后,溶质分别是CH3COONa和NaSCN,依据盐类水解的规律“越弱越水解”,CH3COO-水解程度大于SCN-,即c(CH3COO-)<c(SCN-);②依据电荷守恒,因此有c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-),2c(Ba2+)=c(CH3COO-),推出c(H+)=c(OH-),溶液显中性,根据电离常数的定义:Ka=c(CH3COO-)×c(H+)/c(CH3COOH)= 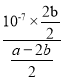 =10-7×2b/(a-2b);(4)考查电极反应式的书写,根据原电池的工作原理,电子从负极经外电路流向正极,即左端电极为负极,通入的是CH3OH,根据示意图,电池内部有H+转移,说明环境是酸性,因此负极反应式为CH3OH+H2O-6e-=CO2+6H+。
=10-7×2b/(a-2b);(4)考查电极反应式的书写,根据原电池的工作原理,电子从负极经外电路流向正极,即左端电极为负极,通入的是CH3OH,根据示意图,电池内部有H+转移,说明环境是酸性,因此负极反应式为CH3OH+H2O-6e-=CO2+6H+。


科目:高中化学 来源: 题型:
【题目】丁苯酞(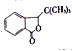 )是国际上首个作用于急性缺血性脑猝中多个病理环节的创新药物,获国家科技进步二等奖。丁苯酞的一种合成路线如下:
)是国际上首个作用于急性缺血性脑猝中多个病理环节的创新药物,获国家科技进步二等奖。丁苯酞的一种合成路线如下:
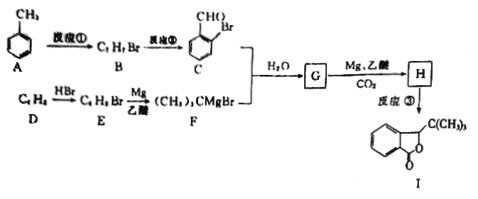
已知: 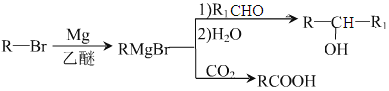
回答下列问题:
(1)H中的含氧官能团的名称是_____________,I的分子式为_______________。
(2)反应①的试剂,条件为_________________,反应②的类型是_________。
(3)G的结构简式为______________________。
(4)由D生成E的化学方程式为____________________。
(5)芳香族化合物M(C8H7OBr)含有和C相同的官能团,其核磁共振氢谱有4组峰,且峰面积之比为2:2:2:1,写出符合条件的所有M的结构简式:_____________________。
(6)参照上述合成路线,以乙醇为原料(其他试剂任选),设计制备CH3CH2COOCH2CH3的合成路线:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烃A,1 mol能与2 mol HCl完全加成生成B,B上的氢原子被Cl原子完全取代需要8 molCl2,则A可能是( )
A. 丙炔B. 2-丁炔C. 2-丁烯D. 2-甲基丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
A. 乙酸乙酯和水,酒精和水,植物油和水
B. 四氯化碳和水,溴苯和水,硝基苯和水
C. 甘油和水,乙酸和水,乙酸和乙醇
D. 汽油和水,苯和甲苯,己烷和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把9.0g乙二酸和某二元醇混合,在一定条件下完全酯化,生成W g环酯和3.6g水,则该醇的相对分子质量可以表示为( )
A. 10W﹣54 B. 5W+13.5 C. 45(W﹣3.6) D. 2W+10.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:
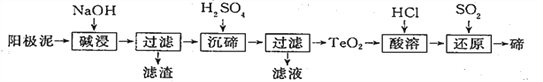
已知TeO2微溶于水,易溶于较浓的强酸和强喊。
(1)“碱浸”时发生反应的离子方程式为____________________。
(2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是______________。
(3)“沉碲”时控制溶液的pH为4. 55. 0,生成TeO2沉淀。酸性不能过强,其原因是_______________;防止局部酸度过大的操作方法是_________。
(4)“酸溶”后,将SO2通人TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是__________。
(5)25°C 时,亚碲酸(H2TeO3) 的Ka1=1×10-3,Ka2=2×10-8。
①0.1 mol·L-1 H2TeO3电离度α约为_____________。(α=![]() ×100%)
×100%)
②0. lmol L-1的NaH TeO3溶液中,下列粒子的物质的量浓度关系正确的是___________。
A.c(Na+ )>c(HTeO3- )>c(OH-)>c(H2TeO3)>c(H+ )
B.c(Na+) + c( H+) >= c(HTeO3- ) +c(TeO32-) +c(OH- )
C.c(Na+ ) =c(TeO32-) +c( HTeO3-) + c( H2TeO3)
D.c(H+)+c(H2TeO3)=c(OH-)+e(TeO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 铵盐不稳定,受热分解都产生氨气
B. N2是空气中的主要成分之一,雷雨时可直接转化为NO2
C. 由于浓硫酸有强氧化性,因此不能用铁罐贮存浓硫酸
D. 浓硝酸不稳定,实验室保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列相关问题:
(1)基态氮原子的价层电子排布式为__________________,碳、氮、氧元素的第一电离能由小到大的顺序为_________________(用元素符号表示)。
(2)NH4Cl中氮原子的杂化方式为____________,与NH4+互为等电子体的一种非极性分子的化学式为_______________。
(3)NH4Cl受热易分解产生氨气,向CuSO4溶液中通入氨气至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,该溶液中存在的配离子的结构式为___________________。
(4)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因__________________________________________________。
(5)第VA族气态氢化物沸点如下图所示,试解释沸点PH33,PH333的原因____________________________________________________________________。

(6)氮化镓是具有重要应用价值的半导体,其部分晶体结构如下图所示,每个晶胞中Ga原子个数为____个,若晶胞底边长为a nm,高为c nm,则氮化镓的晶体密度为___________g/cm3
(用含a、c的代数式表示,阿伏加德罗常数用NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应:2H2(g)+CO(g)![]() CH3OH(g)达到平衡,下列说法正确的是
CH3OH(g)达到平衡,下列说法正确的是
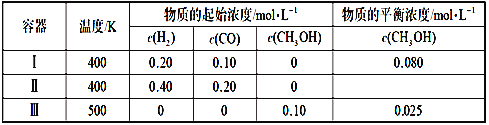
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com