
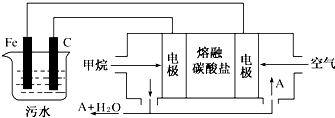


科目:高中化学 来源: 题型:
| A、稀HCl溶液 |
| B、稀Na2SO4溶液 |
| C、CuCl2溶液 |
| D、酸性AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、③⑥ | C、①④ | D、⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向苯酚浊液中加入Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>HCO3- |
| B | 向乙醇中加入浓H2SO4,加热,溶液变黑,将产生的气体通入酸性KMnO4溶液 | KMnO4溶液 褪色 |
该气体是乙烯 |
| C | 向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液X中无NH4+ |
| D | 用湿润的淀粉碘化钾试纸检验气体Y | 试纸变蓝 | 气体Y是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A2 | D2C2 | A2E | DF |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体总浓度(mol/L) 温度(℃) 时间(min) |
15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
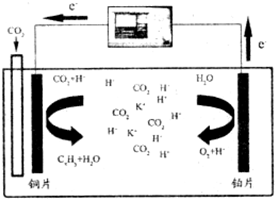
查看答案和解析>>
科目:高中化学 来源: 题型:
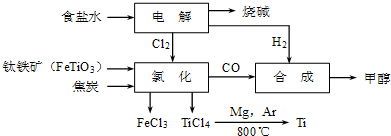
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:
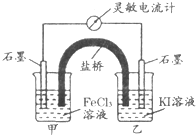 控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )
控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( )| A、反应开始时,甲中石墨电极上Fe3+被还原 |
| B、反应开始时,乙中石墨电极上发生氧化反应 |
| C、电流计读数为最大值时,反应达到化学平衡状态 |
| D、电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com