
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A、该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变 |
| B、因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行 |
| C、根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol?L-1)3 |
| D、达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小 |


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
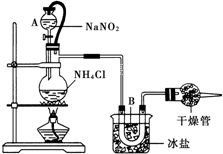 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:
实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气,如图.反应式为:NaNO2+NH4Cl═NaCl+N2↑+2H2O;反应放热.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5mol?L-1 |
| B、2mol?L-1 |
| C、2.5mol?L-1 |
| D、3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 C2H8 |
| B、C2H4 C2H2 |
| C、C2H2 C2H6 |
| D、CH4 C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在其他条件不变时,升高温度可以使平衡向放热反应方向移动 |
| B、在其他条件不变时,使用催化剂只能改变反应速率,而不能使化学平衡移动 |
| C、在容积可变的容器中充入与反应无关的气体,平衡一定不移动 |
| D、在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O |
| B、Zn |
| C、KI |
| D、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
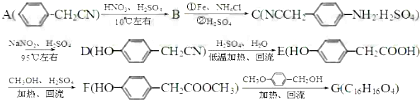
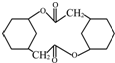 的合成路线流程图(无机试剂任选).合成路线流程图示例:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例:CH3CH2OH| 浓H2SO4 |
| 170℃ |
| Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com