
分析 (1)导致酸雨的气体有二氧化硫和氮的氧化物;
(2)CO与NO反应,生成可参与大气生态环境循环的无毒气体,并在催化剂作用下促使SO2的转化,可知CO与NO反应生成的是N2和CO2,由此即可写出有关化学方程式.
(3)由SO2可催化氧化为SO3,SO3在空气中能形成H2SO4,这也就是“催化转化器”的缺点.
(4)植树造林没有缓解城市空气污染,应该是使用清洁能源和不使用产生污染的能源才行.
解答 解:(1)因导致酸雨的气体有二氧化硫和氮的氧化物,汽车尾气中含CO、SO2和NO等,所以导致酸雨形成的主要物质是SO2和NO,故答案为:SO2、NO;
(2)根据题给信息:CO与NO反应,生成可参与大气生态环境循环的无毒气体.这气体是CO2和N2,所以反应的方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(3)由于“催化转化器”促进了SO2的转化,生成的SO3增多,SO3+H2O=H2SO4,提高了空气的酸度.
故答案为:由于促进了SO2的转化,生成的SO3增多,SO3+H2O═H2SO4提高了空气酸度;
(4)缓解城市空气污染,植树造林能 控制CO2量的增加,而对消除汽车尾气中烃类,故答案为:ABC.
点评 本题以汽车尾气处理这一生活常识为背景材料编写的信息题,为高频考点,侧重于化学与生活的考查,注意用很简单的化学知识加以解释.因此,我们要多关心与化学知识相关系的生产、生活中的热点问题,做到学以致用,难度不大.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
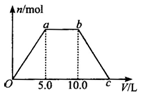 向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:
向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图所示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com