
分析 铁离子具有氧化性,能将碘离子氧化为碘单质,碘单质遇到淀粉显示蓝色;5mL、0.1mol/L KI溶液、5~6滴0.1mol/L FeCl3溶液的混合物中加入0.1mol•L-1 KSCN溶液,如果溶液出现血红色,说明溶液中有没反应的FeCl3溶液,说明此反应为可逆反应.
解答 解:铁离子具有氧化性,能将碘离子氧化为碘单质,碘单质遇到淀粉显示蓝色,发生反应:2Fe3++2I-=2Fe2++I2,加入0.1mol•L-1 KSCN溶液,如果溶液出现血红色,说明溶液中有没反应的FeCl3溶液,5~6滴氯化铁相对于碘离子是少量的,所以可以说明此反应为可逆反应,存在一定的限度,取③静置后的上层清液少量,向其中滴加AgNO3溶液,出现少量黄色沉淀,证明溶液中含有碘离子,但是碘化钾相对于氯化铁是过量的,所以此方法不能证明反应存在一定的限度,
故答案为:2Fe3++2I-=2Fe2++I2;KSCN;溶液出现血红色;不能;碘化钾相对于氯化铁是过量的.
点评 本考点主要考查了化学反应的可逆性知识探究,化学平衡的建立,三价铁离子的检验都属于基础知识的考查,注意灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 物质的量之比为1:1 | B. | 质量之比为4:1 | ||
| C. | 物质的量之比为l:2 | D. | 质量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| W | Z |
| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 电负性大小:Y<Z | |
| C. | 离子半径大小:W<Y | |
| D. | W的最高价氧化物的水化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
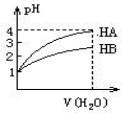 常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )
常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )| A. | 在稀释过程中当两者pH分别都是2时,c(HA)>c(HB) | |
| B. | 当稀释100倍时,HB溶液的pH=2 | |
| C. | 在稀释过程中HA与HB溶液中c(OH-)均增大 | |
| D. | 等体积pH=1的HA和HB溶液分别用等物质的量浓度的NaOH溶液中和,消耗碱溶液体积HA等于HB |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2 的HA溶液与pH=12的MOH溶液等体积混合:c(H+)=c(OH-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强.V正增大,V逆减小 | |
| B. | 升高温度,V正减小,V逆增大 | |
| C. | 增大A浓度的瞬间,V正增大,V逆不变 | |
| D. | 增大A浓度瞬间,V正增大而V逆减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com