
| A、含有不同种元素的纯净物叫做化合物 |
| B、水溶液中能电离出H+的化合物一定是酸 |
| C、盐中一定含有金属元素 |
| D、含有氧元素的化合物一定是氧化物 |


科目:高中化学 来源: 题型:
| A、0L | B、2.24L |
| C、3.36L | D、4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、约为1.2 |
| B、约为7.22×1023 |
| C、约为6.02×1023 |
| D、约为3.01×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶液与过量NaOH溶液反应 NH4++OH-═NH3↑+H2O |
| B、过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O═HCO3-+HClO |
| C、向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将等物质的量浓度的NaHCO3与Na2CO3溶液等体积混合,所得混合液中有:c(CO32-)+2c(OH-)═2c(H+)+c(HCO3-)+3c(H2CO3) |
| B、1L pH=3的H2SO4溶液与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
| C、NaHS溶液呈碱性,是因HS-发生水解,其水解离子方程式为:HS-+H2O?S2-+H3O+ |
| D、pH=9的CH3COONa溶液和pH=9的NH3?H2O溶液,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl
| ||||
| B、AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | ||||
| C、氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | ||||
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24LCO2中含有的原子数为0.3NA |
| B、0.1L3mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| C、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
| D、4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
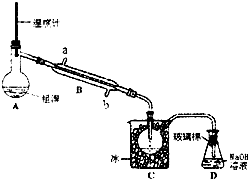 溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为:
溴被称为“海洋元素“.已知Br2的沸点为590C,微溶于水,有毒性和强腐性.实验室模拟从海水中提取溴的主要步骤为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com