
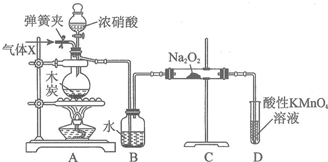
分析 装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置C中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
(1)依据装置特征利用装置中气体压强变化和水柱变化分析判断装置气密性;
(2)物质制备过程中为避免装置中的空气干扰,需要把装置中的空气通入氮气排净后再进行反应,加热制备亚硝酸钠;
(3)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水;
(4)除去未反应的NO,防止污染空气,酸性条件下高锰酸钾氧化一氧化氮为硝酸盐,本身被还原为锰离子;
(5)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳;
(6)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO,③3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,④2NO+Na2O2═2NaNO2,进行计算.
解答 解:(1)连接装置关闭弹簧夹和分液漏斗玻璃活塞,D装置导气管插入水中,微热烧瓶若D装置中导气管处冒气泡,定值加热有一段水柱上升证明气密性完全好;
故答案为:关闭弹簧夹和分液漏斗玻璃活塞,D装置导气管插入水中,微热烧瓶若D装置中导气管处冒气泡,定值加热有一段水柱上升证明气密性完全好;
(2)为避免装置中的空气干扰物质制备,需要把装置中的空气通入氮气排净后再进行反应,加热制备亚硝酸钠,
故答案为:N2,赶出装置中的空气,避免空气影响物质制备;
(3)装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)D装置中反应是除去未反应的NO,防止污染空气,反应的离子方程式为:5NO+3MnO4-+4H+=3Mn2++5NO3-+2H2O,
故答案为:5NO+3MnO4-+4H+=3Mn2++5NO3-+2H2O;
(5)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置E,E中盛放的试剂应碱石灰,用来吸收二氧化碳,
故答案为:NaOH;碱石灰;
(6)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
②3NO2+H2O=2HNO3+NO;
③3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
④2NO+Na2O2═2NaNO2,
则有C~4NO2~$\frac{4}{3}$NO
4NO2~$\frac{8}{3}$HNO3~$\frac{2}{3}$NO
C~($\frac{4}{3}$+$\frac{2}{3}$)=2NO~Na2O2~2NaNO2,
所以3.12g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭的质量为$\frac{3.12g}{78g/mol}$×12g/mol=0.48g,
故答案为:0.48.
点评 本题考查了物质制备的实验过程分析判断,制备原理和实验基本操作是解题关键,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物总能量为679kj | |
| B. | 生成物总能量为431kj | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应放出183kJ能量 | |
| D. | 氢气和氯气反应生成2mol氯化氢气体,反应吸收183kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
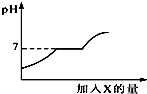 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的物质的量比乙的物质的量小 | |
| C. | 气体摩尔体积:甲<乙 | |
| D. | 甲的相对分子质量比乙的相对分子质量小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com