
| A. | 实验过程中使用四氯化碳时戴防尘口罩 | |
| B. | 实验过程中移取强酸、强碱溶液应带防酸碱手套 | |
| C. | 实验场所严禁携带食物;禁止用饮料瓶装化学药品,防止误食 | |
| D. | 称取粉末状的有毒药品时,要带口罩防止吸入 |
科目:高中化学 来源: 题型:选择题

| A. | 200℃时,该反应的平衡常数为25 | |
| B. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| C. | 200℃时,原平衡中再加入0.4molC,则B的物质的量分数大于25% | |
| D. | 由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡时吸收的热量 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 | Q1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | Q2 |
| A. | T1<T2 | |
| B. | Q1>Q2 | |
| C. | 甲容器中,混合气体的密度始终保持不变 | |
| D. | 乙容器中,反应进行到1.5min时,n(H2O)=1.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiC是氧化产物 | |
| B. | 还原剂与氧化剂的物质的量之比为1:2 | |
| C. | 若生成4.48LCO,则转移0.4 mol 电子 | |
| D. | C 既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中通入少量CO2:CO2+OH-═HCO3- | |
| B. | 碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-NH3↑+H2O | |
| C. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | ③④⑤⑦⑩ | C. | ①③④⑤⑦⑨ | D. | ①③④⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
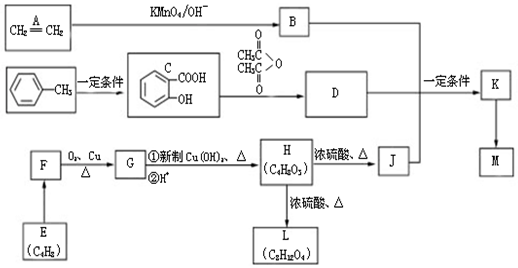

 .
. ,H→J的反应类型消去反应.
,H→J的反应类型消去反应.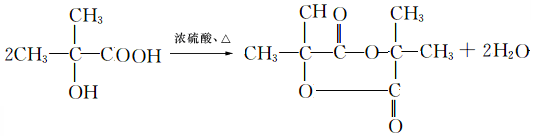 .
. .
.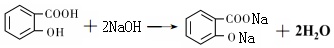 .
.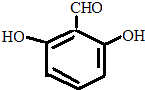 或
或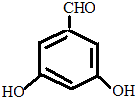 或
或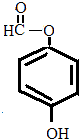 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
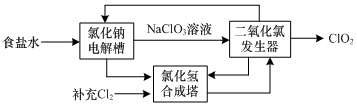
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com