
| A. | 该装置能形成原电池,其中锌是负极 | |
| B. | 该装置能形成原电池,其中铜是负极 | |
| C. | 该装置不能形成原电池 | |
| D. | 以上说法均不正确 |
科目:高中化学 来源: 题型:选择题
| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变条件使平衡正移,反应物的转化率一定增大 | |
| B. | pH=1的醋酸加水稀释,溶液中各离子浓度都减小 | |
| C. | 合成氨反应等温压缩,重新建立平衡时各组分浓度都增大 | |
| D. | pH均为2的盐酸和醋酸分别加水稀释至原来的10倍,水的电离程度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化氢在氧气中燃烧 | B. | 铁在硫蒸气中燃烧 | ||
| C. | 二氧化硫通入石灰水 | D. | 锌粉和硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
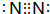 ,e的氢化物的结构式为
,e的氢化物的结构式为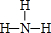 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

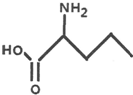 2-氨基戊酸
2-氨基戊酸 含有苯环结构的酯类化合物的同分异构体有6种,它们是:
含有苯环结构的酯类化合物的同分异构体有6种,它们是: 、
、 、
、
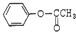 、
、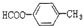 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-丙醇的结构式:CH3CHOHCH3 | |
| B. | 丙烯分子的结构简式为 CH3CH CH 2 | |
| C. | 四氯化碳分子的电子式为: | |
| D. | 2-乙基-1,3-丁二烯的键线式: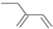 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com